Cho 11,2 gam sắt tác dung với dung dịch loãng có chứa 49gam axit sunfuaric H2SO4. Tính thể tích khí hiđro thu được (Ở đktc)

Những câu hỏi liên quan
Cho 11,2 gam Fe tác dụng với dung dịch H2SO4 loãng có chứa 12,25 gam H2SO4 . Tính thể tích khí H2 thu đc ở đktc.
nH2SO4= 0,125(mol)
nFe=0,2(mol)
PTHH: Fe + H2SO4 -> FeSO4 + H2
Vì: 0,125/1 < 0,2/1
=> Fe dư, H2SO4 hết, tính theo nH2SO4
-> nH2=nH2SO4=0,125(mol)
=>V(H2,đktc)=0,125.22,4=2,8(l)
Đúng 2
Bình luận (0)
Cho 22,4 gam sắt tác dụng với dung dịch loãng có chứa 24,5 gam axit sunfuric.
a) Chất nào còn dư sau phản ứng và dư bao nhiêu gam?
b) Tính thể tích khí hiđro thu được ở đktc.
Cho 22,4g sắt tác dụng với dung dịch loãng có chứa 24,5g axit sunfuric.
a) Chất nào còn dư sau phản ứng và dư bao nhiêu gam?
b) Tính thể tích khí hiđro thu được ở đktc.
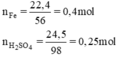
Phương trình hóa học của phản ứng:

So sánh tỉ lệ 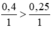 ⇒ Fe dư
⇒ Fe dư
Theo PT nFe (pư) = nH2SO4 = 0,25 mol ⇒ nFe dư = 0,4 – 0,25 = 0,15 mol
mFe dư = 0,15. 56 = 8,4g.
Do khối lượng Fe dư nên tính thể tích khí H2 theo số mol H2SO4.
nH2 = nH2SO4 = 0,25 mol
Vkhí = 0,25 . 22,4 = 5,6l.
Đúng 0
Bình luận (0)
Cho 22,4 gam sắt tác dụng với dung dịch loãng có chứa 24,5 gam axit H2SO4 . a. Tính thể tích khí H2 thu được ở (đktc). b. Chất nào dư sau phản ứng và dư bao nhiêu gam?
\(n_{Fe}=\dfrac{22,4}{56}=0,4\left(mol\right);n_{H_2SO_4}=\dfrac{24,5}{98}=0,25\left(mol\right)\\ PTHH:Fe+H_2SO_4\rightarrow FeSO_4+H_2\\ Vì:\dfrac{0,4}{1}>\dfrac{0,25}{1}\Rightarrow Fe.dư\\ n_{H_2}=n_{Fe\left(p.ứ\right)}=n_{H_2SO_4}=0,25\left(mol\right)\\ a,V_{H_2\left(đktc\right)}=0,25.22,4=5,6\left(l\right)\\ b,n_{Fe\left(dư\right)}=0,4-0,25=0,15\left(g\right)\\ m_{Fe\left(dư\right)}=0,14.56=8,4\left(g\right)\)
Đúng 2
Bình luận (0)
cho 11,2 gam sắt tác dụng với dung dịch loãng có chứa 24,5 gam axit sunfuric H2SO4 a, viết phương trình hóa học xảy ra
b, tính thể tích khid hidro thu đc ( ở đktc)
c, dung dịch sau phản ứng có những chất nào . tính nồng độ % của các dung dịch sau phản ứng , biết dung dịch sau phản ứng có khối lượng là 190 gam
\(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\\
n_{H_2SO_4}=\dfrac{24,5}{98}=0,25\left(mol\right)\\
pthh:Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\)
\(LTL:\dfrac{0,2}{1}< \dfrac{0,25}{1}\)
=> H2SO4 dư
\(n_{H_2}=n_{H_2SO_4\left(p\text{ư}\right)}=n_{Fe}=0,2\left(mol\right)\\
V_{H_2}=0,2.22,4=4,48l\\
m_{H_2SO_4\left(d\right)}=\left(0,25-0,2\right).98=4,9g\)
Đúng 1
Bình luận (0)
Cho 22,4g sắt tác dụng với dung dịch axit sunfuric loãng có chứa 24,5g H₂SO₄ a. Chất nào còn dư sau phản ứng và dư bao nhiêu gam? b. Tính thể tích khí hiđro thu được ở đktc
a) nFe=0,4(mol); nH2SO4=0,5(mol)
PTHH: Fe + H2SO4 -> FeSO4 + H2
Ta có: 0,4/1 < 0,5/1
=> Fe hết, H2SO4 dư. tính theo nFe.
=> nH2= nH2SO4(p.ứ)=nFe=0,4(mol)
=>nH2SO4(dư)=0,5-0,4=0,1(mol)
=>H2SO4(dư)=0,1.98=9,8(g)
b) V(H2,dktc)=0,4.22,4=8,96(l)
Đúng 3
Bình luận (2)
Cho 11,2 g sắt tác dụng với dung dịch loãng có chứa 29,4 g axít sunfuric a) Chất nào còn dư sau phản ứng và dư bao nhiêu gam? b)Tính thể tích khí hiđro được ở đktc c) Đem toàn bộ lượng khí H2 thu được qua 24 gam CuO.Tính khối lượng kim loại thu được
a, \(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
\(n_{H_2SO_4}=\dfrac{29,4}{98}=0,3\left(mol\right)\)
PT: \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
Xét tỉ lệ: \(\dfrac{0,2}{1}< \dfrac{0,3}{1}\), ta được H2SO4 dư.
Theo PT: \(n_{H_2SO_4\left(pư\right)}=n_{Fe}=0,2\left(mol\right)\Rightarrow n_{H_2SO_4\left(dư\right)}=0,3-0,2=0,1\left(mol\right)\)
\(\Rightarrow m_{Fe}=0,1.98=9,8\left(g\right)\)
b, \(n_{H_2}=n_{Fe}=0,2\left(mol\right)\Rightarrow n_{H_2}=0,2.22,4=4,48\left(l\right)\)
c, \(n_{CuO}=\dfrac{24}{80}=0,3\left(mol\right)\)
PT: \(CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
Xét tỉ lệ: \(\dfrac{0,3}{1}>\dfrac{0,2}{1}\), ta được CuO dư.
Theo PT: \(n_{Cu}=n_{H_2}=0,2\left(mol\right)\Rightarrow m_{Cu}=0,2.64=12,8\left(g\right)\)
Đúng 2
Bình luận (0)
Cho 44gam sắt tác dụng với dung dịch loãng có chứa 49 gam axit sunfuric(H2SO4) tạo ra khí Hiđro và sắt (||) Sunfat a,viết phương trình hóa học xảy ra b,tính thể tích hiđro sinh ra c,dẫn toàn bộ lượng khí hiđro thu được qua Mgam cho nung nóng.Tính M
bn hỏi bài này rồi mà :) ? và vẫn không check lại cau c)
bài trc của bn có ng giải rồi đấy :v
Đúng 0
Bình luận (0)
\(n_{Fe}=\dfrac{44}{56}=0,8\left(mol\right)\\ pthh:Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
0,8 0,8
\(V_{H_2}=0,8.22,4=17,92L\\
pthh:CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
0,8 0,8
\(m_{CuO}=0,8.64=51,2g\)
Đúng 0
Bình luận (0)
Cho 44,8 gam Sắt (Fe) tác dụng với dung dịch loãng có chứa 49 gam axit sunfuric (H2SO4), tạo ra khí hiđrô và sắt(II) sunfat
a). Viết phương trình hóa học xảy ra.
b). Tính thể tích khí H2 sinh ra (ở đkc)
c). Dẫn toàn bộ lượng khí hiđro thu được qua m gam CuO nung nóng. Tính m?
a)\(n_{Fe}=\dfrac{44,8}{56}=0,8mol\)
\(n_{H_2SO_4}=\dfrac{49}{98}=0,5mol\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\)
0,8 0,5 0,5 0,5
b)\(V_{H_2}=0,5\cdot22,4=11,2l\)
c)\(CuO+H_2\rightarrow Cu+H_2O\)
0,5 0,5 0,5
\(m_{CuO}=0,5\cdot80=40g\)
Đúng 4
Bình luận (1)





















