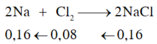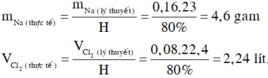Tính m gam Natri và V khí Clo cần dùng để điều chế 4,68 g muối NaCl , hiệu suất phản ứng là 80%

Những câu hỏi liên quan
Tính khối lượng natri và thể tích khí clo cần dùng để điều chế 4,68 g muối natri clorua , bt hiệu suất phản ứng là 80%
Xem chi tiết
PT: \(2Na+Cl_2\underrightarrow{t^o}2NaCl\)
Ta có: \(n_{NaCl}=\dfrac{4,68}{58,5}=0,08\left(mol\right)\)
Theo PT: \(\left\{{}\begin{matrix}n_{Na\left(LT\right)}=n_{NaCl}=0,08\left(mol\right)\\n_{Cl_2\left(LT\right)}=\dfrac{1}{2}n_{NaCl}=0,04\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Na\left(LT\right)}=0,08.23=1,84\left(g\right)\\V_{Cl_2\left(LT\right)}=0,04.22,4=0,896\left(l\right)\end{matrix}\right.\)
Mà: H% = 80%
\(\Rightarrow\left\{{}\begin{matrix}m_{Na\left(TT\right)}=\dfrac{1,84}{80\%}=2,3\left(g\right)\\V_{Cl_2\left(TT\right)}=\dfrac{0,896}{80\%}=1,12\left(l\right)\end{matrix}\right.\)
Bạn tham khảo nhé!
Đúng 2
Bình luận (0)
1) Tính khối lượng Natri và thể tích khí Clo cần dùng để điều chế 4,68 gam muối Natri Clorua, biết hiệu suất phản ứng là 80%.
2) Cho 19,5 gam Zn phản ứng với 7 lít Clo thì thu được 36,72 gam ZnCl2. Tính hiệu suất phản ứng.
3) Nung nóng 12,8 gam Cu với Clo dư. Xác định khối lượng muối CuCl2 thu được. Biết hiệu suất phản ứng là 83%.
4) Nung 12,87 gam NaCl với H2SO4 đặc dư thu được bao nhiêu lít khí và bao nhiêu gam muối Na2SO4, biết hiệu suất phản ứng là 90%.
5) Xác định khối lượng thuốc tím v...
Đọc tiếp
1) Tính khối lượng Natri và thể tích khí Clo cần dùng để điều chế 4,68 gam muối Natri Clorua, biết hiệu suất phản ứng là 80%.
2) Cho 19,5 gam Zn phản ứng với 7 lít Clo thì thu được 36,72 gam ZnCl2. Tính hiệu suất phản ứng.
3) Nung nóng 12,8 gam Cu với Clo dư. Xác định khối lượng muối CuCl2 thu được. Biết hiệu suất phản ứng là 83%.
4) Nung 12,87 gam NaCl với H2SO4 đặc dư thu được bao nhiêu lít khí và bao nhiêu gam muối Na2SO4, biết hiệu suất phản ứng là 90%.
5) Xác định khối lượng thuốc tím và axit HCl cần dùng để điều chế 5,6 lít khí Clo, biết hiệu suất phản ứng là 80%.
6) Từ 1 kg muối ăn (10,5% tạp chất) điều chế được 1250ml dung dịch HCl 36,5% (d=1,2g/ml). Tính hiệu suất của quá trình.
1.
mNaCl lí thuyết = \(\dfrac{4,68.100}{80}\) = 5,85 (g)
=> nNaCl lí thuyết = \(\dfrac{5,85}{58,5}\) = 0,1 (mol)
2Na + Cl2 ----> 2NaCl
0,1 0,05 0,1 (mol)
=> mNa = 0,1.23 = 2,3 (g)
=> VCl2 = 0,05.22,4 = 1,12 (l)
2.
nZn = \(\dfrac{19,5}{65}\)= 0,3 (mol)
nCl2 = \(\dfrac{7}{22,4}\)= 0,3125 (mol)
Zn + Cl2 ----> ZnCl2
0,3 0,3 (mol)
Tỉ lệ: \(\dfrac{0,3}{1}<\dfrac{0,3125}{1}\)=> Zn phản ứng hết, Cl2 phản ứng dư.
=> mZnCl2 lí thuyết 0,3.136 = 40,8 (g)
=> H = \(\dfrac{36,72.100}{40,8}\)= 90%
Đúng 0
Bình luận (0)
3.
Cu + Cl2 ----> CuCl2
0,2 0,2 (mol)
=> mCuCl2 lí thuyết = 0,2.135 = 27 (g)
=> mCuCl2 thực tế = \(\dfrac{27.83}{100}\)= 22,41 (g)
Đúng 0
Bình luận (0)
Khối lượng natri và thể tích khí clo ở điều kiện tiêu chuẩn cần để điều chế 9,36 gam muối NaCl là (biết H 80%) A. 3,68 gam và 2,24 lít B. 3,68 gam và 1,792 lít C. 4,6 gam và 1,792 lít. D. 4,6 gam và 2,24 lít
Đọc tiếp
Khối lượng natri và thể tích khí clo ở điều kiện tiêu chuẩn cần để điều chế 9,36 gam muối NaCl là (biết H = 80%)
A. 3,68 gam và 2,24 lít
B. 3,68 gam và 1,792 lít
C. 4,6 gam và 1,792 lít.
D. 4,6 gam và 2,24 lít
Bài 13. Đốt cháy 4,6 gam Natri trong bình chứa khí Clo .
a) Tính thể tích khí Clo ở đktc
b) Tính khối lượng NaCl thu được, biết hiệu suất phản ứng đạt 80%
c)LấylượngNaClthuđượcởtrênhòatanvàonướcthuđược500gamdungdịch muối. Tính C% dung dịch muối này
Để điều chế được 8,775 gam muối natri clorua (NaCl) thì cần bao nhiêu gam Na ? Biết hiệu suất phản ứng đạt 75%
\(n_{NaCl\left(lt\right)}=\dfrac{8.775}{58.5}=0.15\left(mol\right)\)
\(2Na+Cl_2\underrightarrow{^{t^0}}2NaCl\)
\(0.15..................0.15\)
\(m_{Na\left(tt\right)}=\dfrac{0.15\cdot23}{75\%}=4.6\left(g\right)\)
Đúng 3
Bình luận (0)
nNaCl=\(\dfrac{8,775}{58,5}=0,15\left(mol\right)\)
PTHH 2Na+Cl2---->2NaCl
---------0,15------------0,15
=>nNa(tt)=\(\dfrac{0,15}{75}.100=0,2\left(mol\right)\)
=>mNa(tt)=0,2.23=4,6(g)
Đúng 0
Bình luận (0)
- Câu 8 : Xác định khối lượng thuốc tím cần dùng để điều chế 5,6 lít khí Clo , biết hiệu suất phản ứng là 80% .
- Câu 18 : Cho hh 2 muối MgCO3 và CaCO3 tan trong dd HCl vừa đủ tạo ra 2,24 lít khí (đktc) . Tính số mol của 2 muối cacbonat ban đầu .
Câu 8:
\(n_{Cl_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
PTHH: 2KMnO4 + 16HCl --> 2KCl + 2MnCl2 + 5Cl2 + 8H2O
0,1<---------------------------------0,25
=> \(n_{KMnO_4\left(tt\right)}=\dfrac{0,1.100}{80}=0,125\left(mol\right)\)
=> mKMnO4(tt) = 0,125.158 = 19,75 (g)
Câu 18:
\(n_{CO_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
=> n2 muối cacbonat = 0,1 (mol)
Đúng 3
Bình luận (0)
Câu 8: 2KMnO4 (0,125 mol) + 16HCl (đậm đặc) \(\underrightarrow{H=80\%}\) 2KCl + 2MnCl2 + 5Cl2\(\uparrow\) (0,25 mol) + 8H2O.
Khối lượng thuốc tím cần dùng là 0,125.158=19,75 (g).
Câu 18: 2H+ + CO32- (0,1 mol) \(\rightarrow\) CO2 (0,1 mol) + H2O.
Số mol của hỗn hợp hai muối cacbonat là 0,1 mol.
Đúng 1
Bình luận (0)
Để điều chế được 8,775g muối natri clorua thì cần bao nhiêu gam natri và bao nhiêu lít clo ở đktc. Biết hiệu suất phản ứng là 75%
PTHH: 2Na+Cl2\(\rightarrow\)2NaCl
nNaCl=\(\dfrac{8,775}{58.5}=0,15\left(mol\right)\)
nếu hiệu suất là 100% thì nNaCl=0,15/\(\dfrac{75}{100}\)=0,2(mol)
theo PTHH: nNa=nNaCl=0,2
\(\rightarrow\)mNa=0,2.23=4,6(g)
theo PTHH: nCl2=\(\dfrac{1}{2}\)nNaCl=0,1
\(\rightarrow\)VCl2=0,1.22,4=2,24(l)
Đúng 1
Bình luận (0)
2Na +Cl2 --> 2NaCl
nNaCl=8,775/58,5=0,15(mol)
theo PTHH : nCl2=1/2nNaCl=0,075(mol)
mà H=75% =>nCl2(thực tế)=0,075/75.100=0,1(mol)
=>mCl2=0,1.71=7,1(g)
nNa=nNaCl=0,15(mol)
mà H=75%=>nNa(thực tế )=0,15/75.100=0,2(mol)
=>mNa=0,2.23=4,6(g)
Đúng 0
Bình luận (1)
Tính khối lượng và thể tích khí Clo cần dùng (đktc) để điều chế a,68 gam muối natri clorua. Biết hiệu suất phản ứng là 70 %
2Na+Cl2->2NaCl
nNaCl=4,68/58,5=0,08 mol
=>nNa=0,08 mol
nCl2=0,04 mol
mNa=0,08x23/80%=2,3 g
VCl2=0,04x22,4/70%=1,28 l
Đúng 0
Bình luận (0)
Đốt cháy 3,45 gam natri trong khí clo dư. Khối lượng muối tạo thành sau phản ứng là (biết hiệu suất của phản ứng 80%)
A. 2,070 gam
B. 5,040 gam
C. 8,775 gam
D. 7,020 gam