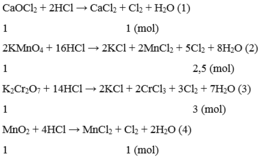nếu lấy KMnO4 và MnO2 với số mol bằng nhau đem đi phản ứng với HCL nóng, dư thì chất nào sinh ra Clo nhiều hơn

Những câu hỏi liên quan
Cho các chất sau: PbO2, MnO2, KMnO4, K2Cr2O7, KClO3, CaOCl2. Lấy hai chất X và Y có số mol bằng nhau trong số các chất trên, đem tác dụng với dung dịch HCl đặc, dư (ở điều kiện thích hợp, phản ứng xẩy ra hoàn toàn) thì thấy thu được số mol khí clo như nhau. Hỏi có bao nhiêu cặp X và Y thỏa mãn? A. 2 B. 3 C. 4 D. 5
Đọc tiếp
Cho các chất sau: PbO2, MnO2, KMnO4, K2Cr2O7, KClO3, CaOCl2. Lấy hai chất X và Y có số mol bằng nhau trong số các chất trên, đem tác dụng với dung dịch HCl đặc, dư (ở điều kiện thích hợp, phản ứng xẩy ra hoàn toàn) thì thấy thu được số mol khí clo như nhau. Hỏi có bao nhiêu cặp X và Y thỏa mãn?
A. 2
B. 3
C. 4
D. 5
Đáp án C
Với bài toán này ta suy luận nhanh như sau:Khí Clo thoát ra như nhau khi số mol e nhận như nhau:
Với PbO2 số oxi hóa Pb thay đổi 2 từ +4 xuống +2
Với MnO2 số oxi hóa Pb thay đổi 2 từ +4 xuống +2
Với KMnO4 số oxi hóa Mn thay đổi 5 từ +7 xuống +2
Với K2Cr2O7 số oxi hóa Cr thay đổi 6 từ +6.2 xuống +3.2
Với KClO3 số oxi hóa Clo thay đổi 6 từ +5 xuống – 1
Với CaOCl2 số oxi hóa Clo thay đổi 2 từ +1 xuống – 1
Vậy có 4 cặp thỏa mãn là :
PbO2 với MnO2 ; PbO2 với CaOCl2 ; MnO2 với PbO2; K2Cr2O7 với KClO3
Đúng 0
Bình luận (0)
Nếu lấy khối lượng KMnO4 , MnO2, KClO3 bằng nhau để cho tác dụng với dd HCl đặc, dư thì chất nào cho nhiều Clo hơn? A. MnO2 B. KClO3 C. KMnO4 D. cả 3 chất như nhau
Đọc tiếp
Nếu lấy khối lượng KMnO4 , MnO2, KClO3 bằng nhau để cho tác dụng với dd HCl đặc, dư thì chất nào cho nhiều Clo hơn?
A. MnO2
B. KClO3
C. KMnO4
D. cả 3 chất như nhau
Đáp án B
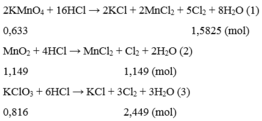
16HCl + 2KMnO4→ 5Cl2+ 2MnCl2+ 2KCl+8H2O
m/15 → m/63,2
6HCl + KClO3 →3Cl2+ KCl+3H2O
m/122,5→ m/40,8
4HCl + MnO2→ Cl2+ MnCl2+ 2H2O
m/87 → m/87
So sánh thấy nếu lấy cùng 1 lượng các chất phản ứng với HCl thì KClO3 cho nhiều khí Cl2 nhất
Đúng 0
Bình luận (0)
Nếu lấy khối lượng
K
M
n
O
4
,
M
n
O
2
,
K
C
l
O
3
bằng nhau để cho tác dụng với dung dịch HCl đặc, dư thì chất nào cho nhiều clo hơn? A.
M
n
O
2
B.
K
C
l
O
3
C.
K
M...
Đọc tiếp
Nếu lấy khối lượng K M n O 4 , M n O 2 , K C l O 3 bằng nhau để cho tác dụng với dung dịch HCl đặc, dư thì chất nào cho nhiều clo hơn?
A. M n O 2
B. K C l O 3
C. K M n O 4
D. Cả 3 chất như nhau
Có những chất sau: KMnO4, MnO2, K2Cr2O7 và dung dịch HCl. a) Nếu các chất oxi hóa có khối lượng bằng nhau thì chọn chất nào có thể điều chế được lượng khí clo nhiều hơn? b) Nếu chất oxi hóa có số mol bằng nhau thì chọn chất nào có thể điều chế được lượng khí clo nhiều hơn? Hãy trả lời bằng cách tính toán trên cơ sở của các phương trình phản ứng.
Đọc tiếp
Có những chất sau: KMnO4, MnO2, K2Cr2O7 và dung dịch HCl.
a) Nếu các chất oxi hóa có khối lượng bằng nhau thì chọn chất nào có thể điều chế được lượng khí clo nhiều hơn?
b) Nếu chất oxi hóa có số mol bằng nhau thì chọn chất nào có thể điều chế được lượng khí clo nhiều hơn?
Hãy trả lời bằng cách tính toán trên cơ sở của các phương trình phản ứng.
a) Giả sử lấy lượng mỗi chất là a gam
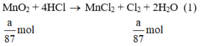
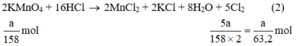
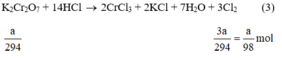
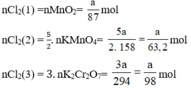
Ta có: 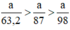
Lượng Cl2 điều chế được từ pt (2) nhiều nhất.
Vậy dùng KMnO4 điều chế được nhiều Cl2 hơn.
b) Nếu lấy số mol các chất bằng a mol
Theo (1) nCl2(1) = nMnO2 = a mol
Theo (2) nCl2(2) = 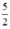 . nKMnO4 = 2,5a mol
. nKMnO4 = 2,5a mol
Theo (3) nCl2(3) = 3. nK2Cr2O7 = 3a mol
Ta có: 3a > 2,5a > a.
⇒ lượng Cl2 điều chế được từ pt (3) nhiều nhất.
Vậy dùng K2Cr2O7 được nhiều Cl2 hơn.
Đúng 0
Bình luận (0)
Nếu cho 1 mol mỗi chất: CaOCl2, KMnO4, K2Cr2O7, MnO2 lần lượt phản ứng với lượng dư dung dịch HCl đặc, chất tạo ra lượng chất Cl2 nhiều nhất là A. K2Cr2O7 B. MnO2 C. CaOCl2 D. KMnO4
Đọc tiếp
Nếu cho 1 mol mỗi chất: CaOCl2, KMnO4, K2Cr2O7, MnO2 lần lượt phản ứng với lượng dư dung dịch HCl đặc, chất tạo ra lượng chất Cl2 nhiều nhất là
A. K2Cr2O7
B. MnO2
C. CaOCl2
D. KMnO4
Đáp án A
Đáp án A do Cr nhường 6e (có 2 nguyên tử Cr), nhường nhiều e nhất nên tạo ra nhiều khí nhấ
Đúng 0
Bình luận (0)
Nếu cho 1 mol mỗi chất: CaOCl2, KMnO4, K2Cr2O7, MnO2 lần lượt phản ứng với lượng dư dung dịch HCl đặc, chất tạo ra lượng khí nhiều nhất là A. KMnO4 B. K2Cr2O7 C. CaOCl2 D. MnO2
Đọc tiếp
Nếu cho 1 mol mỗi chất: CaOCl2, KMnO4, K2Cr2O7, MnO2 lần lượt phản ứng với lượng dư dung dịch HCl đặc, chất tạo ra lượng khí nhiều nhất là
A. KMnO4
B. K2Cr2O7
C. CaOCl2
D. MnO2
Trong phản ứng với HCl đặc thì chất nào nhận electron nhiều nhất thì cho lượng Cl2 lớn nhất.
Giả sử có 1 mol mỗi chất CaOCl2, KMnO4, K2Cr2O7, MnO2 lần lượt phản ứng với lượng dư dung dịch HCl đặc thì số mol electron nhận lần lượt là 2 mol, 5 mol, 6 mol, 2 mol.
Vậy chất tạo ra lượng khí Cl2 nhiều nhất là K2Cr2O7. Đáp án B.
Đúng 0
Bình luận (0)
Nếu cho 1 mol mỗi chất:
C
a
O
C
l
2
,
K
M
n
O
4
,
K
2
C
r
2
O
7
,
M
n
O
2
lần lượt phản ứng với lượng dư dung dịch HCl đặc, chất tạo ra lượng khí
C
l
2
nhiều nhất là A.
K...
Đọc tiếp
Nếu cho 1 mol mỗi chất: C a O C l 2 , K M n O 4 , K 2 C r 2 O 7 , M n O 2 lần lượt phản ứng với lượng dư dung dịch HCl đặc, chất tạo ra lượng khí C l 2 nhiều nhất là
A. K M n O 4
B. C a O C l 2
C. K 2 C r 2 O 7
D. M n O 2
Nếu cho 1 mol mỗi chất:
C
a
O
C
l
2
,
K
M
n
O
4
,
K
2
C
r
2
O
7
,
M
n
O
2
lần lượt phản ứng với lượng dư dung dịch HCl đặc, chất tạo ra lượng khí...
Đọc tiếp
Nếu cho 1 mol mỗi chất: C a O C l 2 , K M n O 4 , K 2 C r 2 O 7 , M n O 2 lần lượt phản ứng với lượng dư dung dịch HCl đặc, chất tạo ra lượng khí C l 2 nhiều nhất là
A. C a O C l 2
B. K M n O 4
C. K 2 C r 2 O 7
D. M n O 2
Chọn đáp án C
C a O C l 2 + 2HCl → C a C l 2 + C l 2 + H 2 O
1 1 mol
2 K M n O 4 + 16HCl → 2KCl + 2 M n C l 2 + 5 C l 2 + 8 H 2 O
1 2,5 mol
K 2 C r 2 O 7 + 14HCl → 2KCl + 2 C r C l 3 + 3 C l 2 + 7 H 2 O
1 3 mol
M n O 2 + 4HCl → M n C l 2 + C l 2 + 2 H 2 O
1 1 mol
Vậy nếu cho cùng 1 mol mỗi chất C a O C l 2 , K M n O 4 , K 2 C r 2 O 7 , MnO2 thì K 2 C r 2 O 7 cho lượng khí C l 2 nhiều nhất.
Đúng 0
Bình luận (0)
Cho các chất KMnO4 ; MnO2; HCl
a/ Nếu khối lượng các chất KMnO4 và MnO2 bằng nhau chọn chất nào để có thể điều chế được khí clo nhiều nhất
b/ Mết số mol của KMnO4 và MnO2 bằng nhau, thì chọn chất nào để điều chế được khí clo nhiều nhất
c/ Nếu muốn điều chế 1 thể tích clo nhất định thì chon KMnO4 hay MnO2 để tiết kiệm HCl
a) - Nếu dùng KMnO4:
2 KMNO4 + 16 HCl = 2 KCl + 2 MnCl2 + 8 H2O + 5 Cl2 (1)
- Nếu dùng MnO2:
MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O (2)
Theo pt ta thấy (1) tạo ra 5Cl2 còn pư (2) chỉ tạo 1Cl2, chứng tỏ (1) tạo ra nhiều clo hơn (2).
b) giả sử số mol của KMnO4 và MnO2 là 0.2 mol
2 KMNO4 + 16 HCl = 2 KCl + 2 MnCl2 + 8 H2O + 5 Cl2 (1)
0.2.................................................................................0.5
MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O (2)
0.2........................................0.2
Ta thấy số mol Cl2 ở (1) lớn hơn số mol Cl2 ở (2), suy ra pư (1) tạo nhiều clo hơn (2).
c) Từ (1) và (2) ta thấy:
Số mol HCl (1) lớn gấp 4 lần số mol HCl ở (2), suy ra ở pư (1) tiêu tốn HCl hơn pư (2).
Để thu được nhiều Clo hơn ta nên dùng pư (1) , còn muốn tiết kiệm HCl ta nên dùng MnO2.
Đúng 0
Bình luận (0)