bỏ Mg vào 1,2l dd Sắt(III) chloride 0,1M. sau pư ht thu đc 0.00336 kg kết tủa. kl Mg là

Những câu hỏi liên quan
cho 5,1g hỗn hợp X gồm Mg và Al pư vs m(g) dd hcl 10%( vừa đủ) thu đc dd A và 5,6(l) khí a) tính thành phần % khối lượng mỗi kl trong X b) tính m c) cho toàn bộ dd A pư vs dd NaOH thu đc a(g) kết tủa tính a
a)
Gọi $n_{Mg} = a ; n_{Al} = b \Rightarrow 24a + 27b = 5,1(1)$
$Mg + 2HCl \to MgCl_2 + H_2$
$2Al + 6HCl \to 2AlCl_3 + 3H_2$
Ta có :
$n_{H_2} = a + 1,5b = \dfrac{5,6}{22,4} = 0,25(2)$
Từ (1)(2) suy ra a = b = 0,1
$\%m_{Mg} = \dfrac{0,1.24}{5,1}.100\% =47,06\%$
$\%m_{Al} = 52,94\%$
b)
$n_{HCl} = 2n_{H_2} = 0,5(mol)$
$m_{dd\ HCl} = \dfrac{0,5.36,5}{10\%} = 182,5(gam)$
c)
$MgCl_2 + 2NaOH \to Mg(OH)_2 + 2NaCl$
$AlCl_3 + 3NaOH \to Al(OH)_3 + 3NaCl$
$Al(OH)_3 + NaOH \to NaAlO_2 + 2H_2O$
$n_{Mg(OH)_2} = a = 0,1(mol)$
$\Rightarrow m_{kết\ tủa} = 0,1.58 = 5,8(gam)$
Đúng 3
Bình luận (0)
Ta có:
\(Mg+2HCl\rightarrow MgCl_2+H_2\) ; \(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
Đặt số mol Mg và Al lần lượt là a và b (a,b>0)
theo bài ra ta có hệ
\(\left\{{}\begin{matrix}24a+27b=5,1\\a+1,5b=\dfrac{5,6}{22,4}\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,1\\b=0,1\end{matrix}\right.\)
\(\Rightarrow\%Mg=\dfrac{0,1\times24}{5,1}=47,06\%\Rightarrow\%Al=100\%-47,06\%=52,94\%\)
Theo PT có \(n_{HCl}=2n_{Mg}+3n_{Al}=2\times0,1+3\times0,1=0,5\left(mol\right)\)
\(\Rightarrow m_{HCl}=0,5\times36,5=18,25\left(g\right)\Rightarrow m_{ddHCl}=\dfrac{18,25}{10\%}=182,5\left(g\right)\)
\(MgCl_2+2NaOH\rightarrow Mg\left(OH\right)_2\downarrow+2NaCl\)
\(AlCl_3+3NaOH\rightarrow Al\left(OH\right)_3\downarrow+3NaCl\)
+ Với NaOH vừa đủ
\(a=m_{Mg\left(OH\right)_2}+m_{Al\left(OH\right)_3}=0,1\times58+0,1\times78=13,6\left(g\right)\)
+ Với NaOH dư có thêm PT
\(Al\left(OH\right)_3+NaOH\rightarrow NaAlO_2+2H_2O\)
\(\Rightarrow a=m_{Mg\left(OH\right)_2}=0,1\times58=5,8\left(g\right)\)
Đúng 1
Bình luận (0)
Cho V ml dd chứa CuSO4 0,2M; MgSO4 0,1M và FeSO4 0,2M phản ứng vừa đủ với dd NaOH, sau phản ứng thu đc kết tủa. Lọc kết tủa đem nung kết tủa đến khối lượng không đổi, thu đc 18g chất rắn khan. Tính gtri của V.
Cho Cu = 64, Mg = 24, Fe = 56, O = 16
Đề không đề cập nung trong điều kiện nào nên mình coi như nung trong không khí nhé.
PT: \(CuSO_4+2NaOH\rightarrow Cu\left(OH\right)_2+Na_2SO_4\)
\(MgSO_4+2NaOH\rightarrow Mg\left(OH\right)_2+Na_2SO_4\)
\(FeSO_4+2NaOH\rightarrow Fe\left(OH\right)_2+Na_2SO_4\)
\(Cu\left(OH\right)_2\underrightarrow{t^o}CuO+H_2O\)
\(Mg\left(OH\right)_2\underrightarrow{t^o}MgO+H_2O\)
\(4Fe\left(OH\right)_2+O_2\underrightarrow{t^o}2Fe_2O_3+4H_2O\)
Giả sử dd chứa a (l)
Ta có: nCuSO4 = 0,2a (mol), nMgSO4 = 0,1a (mol), nFeSO4 = 0,2a (mol)
Theo PT: \(\left\{{}\begin{matrix}n_{CuO}=n_{Cu\left(OH\right)_2}=n_{CuSO_4}=0,2a\left(mol\right)\\n_{MgO}=n_{Mg\left(OH\right)_2}=n_{MgSO_4}=0,1a\left(mol\right)\\n_{Fe_2O_3}=\dfrac{1}{2}n_{Fe\left(OH\right)_2}=\dfrac{1}{2}n_{FeSO_4}=0,1a\left(mol\right)\end{matrix}\right.\)
⇒ 0,2a.80 + 0,1a.40 + 0,1a.160 = 18
⇒ a = 0,5 (l)
⇒ V = 500 (ml)
Đúng 3
Bình luận (0)
B1:cho 2,81g hh Fe203,Mg0,Zn0 tan vừa đủ trong 300ml dd H2S04 0,1M cô cạn dd sau pư thu đc m(g) muối .xác định m
B2:1 dd chứa 38,2g hh 2 muối sunfat của kim loại kiềm A hóa trị 1 và kim loại kiềm thể B tác dụng vừa đủ với dd BaCl2 thu đc 69,9g kết tủa,lọc bỏ kết tủa cô cạn dd sau pư thu đc m(g) muối.xác định m
B1
300 ml = 0,3 l
n H2SO4 = CM.V = 0,1.0,3 = 0,03 mol
H2SO4 --> 2H(+) + SO4(2-)
0,03 -------> 0,06 -------> 0,03 (mol)
2H(+) + O(2-) --> H2O
0,06 ---> 0,03 (mol)
Vậy khối lượng muối Sufat là : 2,81 + 0,03.96 - 0,03.16 = 5,21 g
Đúng 0
Bình luận (0)
cho 18,8 g hỗn hợp gồm Mg và oxit sắt vào 200 g dd axit clohidric 18,25%.Sau pư kết thúc thu đc 6,72 lít khí .ttimf chức oxit sắt
Hòa tan hoàn toàn 6,3175g hh muối gồm NaCl,KCl,MgCl2 vào nước rồi thêm vào đó 100ml dd AgNO3 1,2M sau pứ lọc tách kết tủa A thu đc dd B. Cho 2g Mg vào dd B pứ kết thúc đc kết tủa C và dd D. Cho kết tủa C tác dụng với dd HCl dư pứ sau pứ thấy klg C giảm đi 1,844g. Thêm NaOH dư vào dd D lọc kết tủa đem nung đến klg ko đổi thu đc 0,3g chất rắn E.a) Tính klg các kết tủa A và Cb) Tính % klg các muối có trong hh bđ
Đọc tiếp
Hòa tan hoàn toàn 6,3175g hh muối gồm NaCl,KCl,MgCl2 vào nước rồi thêm vào đó 100ml dd AgNO3 1,2M sau pứ lọc tách kết tủa A thu đc dd B. Cho 2g Mg vào dd B pứ kết thúc đc kết tủa C và dd D. Cho kết tủa C tác dụng với dd HCl dư pứ sau pứ thấy klg C giảm đi 1,844g. Thêm NaOH dư vào dd D lọc kết tủa đem nung đến klg ko đổi thu đc 0,3g chất rắn E.
a) Tính klg các kết tủa A và C
b) Tính % klg các muối có trong hh bđ
B1:hòa tan hỗn hợp X gồm 11,2g Fe và 2,4g Mg bằng dd H2S04(loãng) dư thu đc đ Y.cho dd NaOH dư vào Y thu đc kết tủa Z nung Z trong không khí đến kl không đổi thu đc m(g) chất rắn.biết các pư xảy ra hoàn toàn .viết phương trình phản ứng,xác định mB2:cho 1,75g hh Fe,Al,Zn tác dụng với dd HCl dư thu đc 1,12 lít khí ở đktc khô cạn đ sau pư thu đc m(g) muối.xác định m B3:cho 32g 1 oxit của lim loại hóa trị 3 tác dụng hết với 294g dd H2S04 20%.xác định công tức oxit
Đọc tiếp
B1:hòa tan hỗn hợp X gồm 11,2g Fe và 2,4g Mg bằng dd H2S04(loãng) dư thu đc đ Y.cho dd NaOH dư vào Y thu đc kết tủa Z nung Z trong không khí đến kl không đổi thu đc m(g) chất rắn.biết các pư xảy ra hoàn toàn .viết phương trình phản ứng,xác định m
B2:cho 1,75g hh Fe,Al,Zn tác dụng với dd HCl dư thu đc 1,12 lít khí ở đktc khô cạn đ sau pư thu đc m(g) muối.xác định m
B3:cho 32g 1 oxit của lim loại hóa trị 3 tác dụng hết với 294g dd H2S04 20%.xác định công tức oxit
B3: Gọi M là tên kim loại hóa trị III=>oxit của nó là M2O3
mct(H2SO4)=294*20/100=58.8(g)
=>nH2SO4=58.8/98=0.6(mol)
M2O3+3H2SO4=>M2(SO4)3+3H2O
0.2----->0.6(mol)
=>nM2O3=0.6/3=0.2(mol)
=>M2O3=32/0.2=160(g)
=>M=160-48/2=56(g)=>Fe
Vậy công thức của oxit kim loại là Fe2O3.
Đúng 0
Bình luận (0)
Cho 6 lít hh CO2 và N2 (đktc) đi qua dd NaOH . sau pư thu đc dd X. cho BaCl2 vào X được 2,955 g kết tủa, lọc bỏ kết tủa được dd Y. cho Ba(OH)2 dư vào Y được 11,82 g kết tủa. tính % V(CO2) trog hh ban đầu
Khi cho hỗn hợp khí vào dung dịch NaOH thì chỉ có khí CO2 phản ứng với NaOH ( Chú ý đề thiếu, NaOH phải dư nhé!)
\(CO_2+2NaOH--->Na_2CO_3+H_2O\) (1)
0,075 <-----------------------------------------0,075 (mol)
Dung dịch X là Na2CO3 .
\(Na_2CO_3+BaCl_2--->BaCO_3\downarrow+2NaCl\)(2)
0,015 <----------------------------------------0,015 (mol)
Kết tủa là BaCO3, dung dịch Y gồm NaCl và có thể là BaCl2 dư hoặc Na2CO3 dư
Cho dung dịch Y vào Ba(OH)2 xuất hiện kết tủa nên dung dịch Y sẽ là có Na2CO3 dư.
\(Na_2CO_3+Ba\left(OH\right)_2--->BaCO_3\downarrow+2NaOH\) (3)
0, 06 <----------------------------------------- 0,06 (mol)
Ta có: \(n_{BaCO_3\left(2\right)}=\frac{2,955}{137+12+16.3}=0,015\left(mol\right)\)
\(n_{BaCO_3\left(3\right)}=\frac{11,82}{137+12+16.3}=0,06\left(mol\right)\)
=> \(n_{Na_2CO_3\left(X\right)}=0,015+0,06=0,075\left(mol\right)\)
=> \(n_{CO_2}=0,075\left(mol\right)\)=> \(V_{CO_2}=0,075.22,4=1,68\left(l\right)\)
=> \(\%V_{CO_2}=\frac{1,68}{6}.100\%=28\%\)
Đúng 1
Bình luận (0)
Cho mg hh M gồm Fe2O3, FeO, Cu vào dd HCl 2M, kết thúc pư chỉ còn lại 1,5 g Cu và dd M1, thêm tiếp vào dd M1 dd NaOh 2M cho đến khi thu được kết tủa lớn nhất dừng lại thì thể tích dd NaOH cần dùng là 400ml. Lọc lấy kết tủa rồi đem nung trong ko khí đến khi khối lượng không đổi thì thu đc 16g chất rắna/ Tính V dd hcl đã dùngb/ Tính khối lượng từng chất có trong dd M? Biết số mol 2 oxit trong M bằng nhau
Đọc tiếp
Cho mg hh M gồm Fe2O3, FeO, Cu vào dd HCl 2M, kết thúc pư chỉ còn lại 1,5 g Cu và dd M1, thêm tiếp vào dd M1 dd NaOh 2M cho đến khi thu được kết tủa lớn nhất dừng lại thì thể tích dd NaOH cần dùng là 400ml. Lọc lấy kết tủa rồi đem nung trong ko khí đến khi khối lượng không đổi thì thu đc 16g chất rắn
a/ Tính V dd hcl đã dùng
b/ Tính khối lượng từng chất có trong dd M? Biết số mol 2 oxit trong M bằng nhau
Cho m(g) Mg vào dung dịch chứa 0,1 mol AgNO3 và 0.25 mol Cu(NO3)2, sau một thời gian thu được 19,44g kết tủa và dung dịch X chứa 2 muối. Tách lấy kết tủa, thêm tiếp 8,4g bột sắt vào dd X, sau khi các phản ứng hoàn toàn, thu được 9,36g kết tủa. Giá trị của m là: A. 4,8g B. 4,32g C. 4,64g D. 5,28g
Đọc tiếp
Cho m(g) Mg vào dung dịch chứa 0,1 mol AgNO3 và 0.25 mol Cu(NO3)2, sau một thời gian thu được 19,44g kết tủa và dung dịch X chứa 2 muối. Tách lấy kết tủa, thêm tiếp 8,4g bột sắt vào dd X, sau khi các phản ứng hoàn toàn, thu được 9,36g kết tủa. Giá trị của m là:
A. 4,8g
B. 4,32g
C. 4,64g
D. 5,28g
Chọn đáp án C
Ta có :![]()
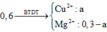
Vậy 9,36 chất rắn là gì ?
Đương nhiên là Fe và Cu
![]()
![]()
![]()
Đúng 0
Bình luận (0)



















