Cho 22,7g kim loại R hóa trị III tác dụng với 1,232l O2(đktc) . Tìm kim loại R

Những câu hỏi liên quan
Cho 22,7g kim loại R hóa trị III tác dụng với 1,232l O2(đktc) . Tìm kim loại R
td vs o2 r nó có ra cái j để giả sử pứ k bn
Đúng 0
Bình luận (1)
Kim loại R có hóa trị III, cho 12,6g R tác dụng vừa đủ với 8,96l hỗn hợp khí A gồm Cl2 và O2. Bt tỉ khối giữa hỗn hợp khí A so với H2 là 20,875. Xác định kim loại R
Cho 10,8g kim loại R có hóa trị III tác dụng với dung dịch HCl thấy tạo thành 53,4g muối.
a) Xác định tên loại R đó.
b) Cho 13,5g kim loại R trên tan hoàn toàn trong dung dịch axit HCl 0,5M. Tính: thể tích khí H2 thoát ra(đktc); thế tích dung dịch HCl cần dùng ?
*trình bày chi tiết giúp mình với ạ
\(PTHH:2R+6HCl\rightarrow2RCl_3+3H_2\)
\(TheoPTHH:n_R=n_M=\dfrac{10,8}{R}=\dfrac{53,4}{R+35,5.3}\)
\(\Rightarrow R=27\)
=> Kim loại đó là Nhôm
b, \(TheoPTHH:n_{HCl}=3n_R=1,5mol\)
\(\Rightarrow V_{HCl}=3l\)
Theo PTHH : \(n_{H2}=\dfrac{3}{2}n_{Al}=0,75mol\)
\(\Rightarrow V=n.22,4=16,8l\)
Đúng 1
Bình luận (1)
\(2M+6HCl\rightarrow2MCl_3+3H_2\)
\(2M...........2\cdot\left(M+106.5\right)\)
\(10.8..................53.4\)
\(53.4\cdot2M=10.8\cdot\cdot2\left(M+106.5\right)\)
\(\Rightarrow M=27\)
\(M:Nhôm\)
\(n_{Al}=\dfrac{13.5}{27}=0.5\left(mol\right)\)
\(V_{H_2}=0.5\cdot\dfrac{3}{2}\cdot22.4=16.8\left(l\right)\)
\(V_{dd_{HCl}}=\dfrac{0.5\cdot6}{2\cdot0.5}=3\left(l\right)\)
Đúng 2
Bình luận (1)
6,72l khí oxi tác dụng vừa đủ với 10.8g kim loại R.hãy xác định kim loại R và viết CTHH của oxit R ( Biết hóa trị của kim loại R không quá III)
PTHH: \(4R+xO_2\underrightarrow{t^o}2R_2O_x\) (Với x là hóa trị của R)
Ta có: \(n_{O_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
\(\Rightarrow n_R=\dfrac{1,2}{x}\left(mol\right)\) \(\Rightarrow M_R=\dfrac{10,8}{\dfrac{1,2}{x}}=9x\)
Ta thấy với \(x=3\) thì \(M_R=27\) (Nhôm)
Vậy công thức oxit là Al2O3
Đúng 1
Bình luận (0)
cho một kim loại R hóa trị 3 tác dụng hoàn toàn với 3,36l khí oxi (đktc) thu được 10,2g oxit . xác định kim loại R
PTHH : 4R + 3O2 ---> 2R2O3
nO2 = 0,15 ( mol )
nR = 4/3 . nO2 = 0,2 ( mol )
nR2O3 = 0,1 ( mol )
=> M = 10,2 : 0,1 = 102 ( đvC )
Ta có:
R.2 + 16.3 = 102
-> R = 27 ( Al )
Đúng 1
Bình luận (0)
\(n_{O2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
Pt : \(4R+3O_2\underrightarrow{t^o}2R_2O_3|\)
4 3 2
0,2 0,15
Theo định luật bảo toàn khối lượng :
\(m_R+m_{O2}=m_{R2O3}\)
\(m_R+\left(0,15.32\right)=10,2\)
⇒ \(m_R=10,2-4,8=5,4\left(g\right)\)
\(n_R=\dfrac{0,15.4}{3}=0,2\left(mol\right)\)
⇒ \(M_R=\dfrac{5,4}{0,2}=27\) (g/mol)
Vậy kim loại R là nhôm
Chúc bạn học tốt
Đúng 1
Bình luận (0)
Gọi công thức là R
n O2=\(\dfrac{3,36}{22,4}\)=0,15 mol
4R +3O2-to>2R2O3
4--------3-------2(2MR+48)
0,15mol----10,2g
=>\(\dfrac{3}{0,15}\dfrac{2\left(2MR+48\right)}{10,2}\)
=>MR=27 đvC
=>R là nhôm (Al)
Đúng 1
Bình luận (0)
Xem thêm câu trả lời
Cho 40,5 gam kim loại R (có hóa trị không đổi) tác dụng với dung dịch axit clohiđric dư thu được 50,4 lít khí (đktc). Kim loại R là
A. Mg
B. Al
C. Zn
D. Fe
cho 1,2g kim loại R có hóa trị II tác dụng với dd HCl dư, sau phản ứng thu đc 1,12lit H2(đktc).Xác định tên kim loại R?
\(n_{H_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
PTHH: R + 2HCl --> RCl2 + H2
0,05<---------------0,05
=> \(M_R=\dfrac{1,2}{0,05}=24\left(g/mol\right)\)
=> R là Mg (Magie)
Đúng 4
Bình luận (1)
cho 6,5g kim loại R(hóa trị 2) tác dụng với hcl sinh ra 2,24l khí(đktc) xác định tên kim loại đó
\(R+2HCl\rightarrow RCl_2+H_2\\ n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\\ n_R=n_{H_2}=0,1\left(mol\right)\\ M_R=\dfrac{6,5}{0,1}=65\left(\dfrac{g}{mol}\right)\\ \Rightarrow R\left(II\right):Kẽm\left(Zn=65\right)\)
Đúng 3
Bình luận (0)
R+ 2HCl →RCl2 + H2
0,1 ← 0,1 mol
n H2 = 2,24:22,4=0,1 mol
n R =6,5/MR
=> 6,5/MR =0,1 => MR =65
=> R là kẽm (Zn)
Đúng 0
Bình luận (0)
Cho 40,5 gam kim loại R (có hóa trị không đổi) tác dụng với dung dịch axit clohiđric dư thì thu được 50,4 lít khí (đktc). Kim loại R là
A. Mg.
B. Al.
C. Zn.
D. Fe.
Đáp án B
2R + 2nHCl → 2RCln + nH2↑
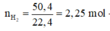
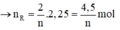
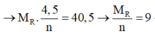
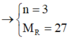
Vậy R là nhôm (Al)
Đúng 0
Bình luận (0)




























