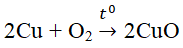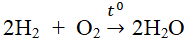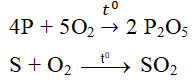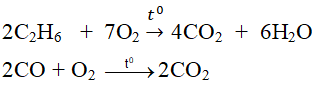nêu ví dụ về một phản ứng hóa học,trong đó có oxi

Những câu hỏi liên quan
1. Nêu tính chất hóa học của oxi, hiđro. Viết phương trình hóa học minh họa.
2. Viết PTHH để điều chế H2, O2 trong phòng thí nghiệm.
3. Nêu khái niệm, cách gọi tên, phân loại oxit. Lấy ví dụ minh họa.
4. Nêu tên, khái niệm, ví dụ về các loại phản ứng hóa học đã học.
5. Nêu ứng dụng của oxi, hiđro.
a.Phản ứng hóa hợp, phản ứng phân hủy là gì? Lấy ví dụ
b. Sự oxi hóa là gì? Sự cháy là gì, sự oxi hóa chậm là gì? Lấy ví dụ
c . Nêu thành phần không khí, nguyên nhân gây ô nhiễm không khí, các biện pháp bảo vệ không khí trong lành.
d. Nêu điều kiện phát sinh và các biện pháp dập tắt đám cháy.
câu a:
phản ứng hóa hợp là: pứ Có 2 hoặc nhìu hợp chất tham gia chỉ tạo ra 1 hợp chất sp.
\(4K+O_2\underrightarrow{t^o}2K_2O\)
phản ứng phân hủy là : pứ chỉ có 1 chất nhưng tạo ra 2 hoặc nhiều chất.
\(2KMnO_4\rightarrow MnO_2+K_2MnO_4+O_2\uparrow\)
câu b:
--->Sự oxi hóa là sự tác dụng của oxi với một chất (chất đó có thể là đơn chất hoặc hợp chất).
- Ví dụ: Sự oxi hóa cacbon
câu c
-->Sự cháy là sự oxi hóa có tỏa nhiệt và phát sáng.
Ví dụ: Nến cháy, khí gas cháy,...
----Sự oxi hóa chậm là :
+ sự oxi hóa có tỏa nhiệt nhưng không phát sáng.
+ thường xảy ra trong tự nhiên như các đồ vật bằng gang sắt thép trong tự nhiên dần dần biến đổi thành sắt oxit.
Sự oxi hóa chậm các chất hữu cơ trong cơ thể luôn diễn ra và tạo ra năng lượng đó giúp cơ thể hoạt động được
Đúng 1
Bình luận (0)
Câu 1. Nêu tính chất hóa học a/của oxi ví dụ về sự oxi hóa
Tham khảo:
Câu 1:
Khí oxi là một đơn chất phi kim rất hoạt động, đặc biệt ở nhiệt độ cao, dễ dàng tham gia phản ứng hóa học với nhiều phi kim, nhiều kim loại và hợp chất. Trong các hợp chất hóa học, nguyên tố oxi có hóa trị II.
Cụ thể:
- Tác dụng với kim loại: O2 oxi hóa được hầu hết các kim loại trừ Ag, Au, Pt.
Ví dụ:
- Tác dụng với hiđro, phản ứng có thể gây nổ mạnh nếu tỉ lệ thể tích O2 : H2 = 1:2
Phương trình hóa học:
- Tác dụng với một số phi kim khác:
Ví dụ:
+ Tác dụng với một số hợp chất:
Ví dụ:
Đúng 1
Bình luận (0)
nêu tính chất hóa học và mỗi tính chất viêt ví dụ một phương trình phản ứng của các chất:
a.oxi
b.hidro
c.nước
Oxi: Tính chất hóa học : oxi là một đơn chất phi kim hoạt động mạnh, đặc biệt là ở nhiệt độ cao, dễ dàng tham gia phản ứng hóa học với nhiều phi kim, nhiều kim loại và hợp chất. Trong các hợp chất hóa học, nguyên tố oxi có hóa trị II.
2SO2 + O2 → 2SO3
2Fe + O2 + 2H2O → 2Fe(OH)2
C5H12O2 + 7O2 → 5CO2 + 6H2O
Hidro: Tính chất hóa học
- Hidro là phi kim, Hydro có hóa trị 1 và có thể phản ứng với hầu hết các nguyên tố hóa học khác.
Bị kim loại (Fe, Ni, Pt, Pd) hấp thụ hóa học. Chất khử mạnh ở nhiệt độ cao. Hiđro nguyên tử Ho có khả năng khử đặc biệt cao, được tạo nên khi nhiệt phân hiđro phân tử H2 hay do phản ứng trực tiếp trong vùng tiến hành quá trình khử.
a. Tác dụng với kim loại
- Hidro tác dụng được với nhiều kim loại mạnh tạo hợp chất hidrua.
Ví dụ: H2 + 2Na → 2NaH (natri hidrua)
b. Tác dụng với phi kim: Hidro tác dụng được với nhiều phi kim
H2 + Cl2 → 2HCl
2H2 + O2 → 2H2O
3H2 + N2 → 2NH3.
c. Tác dụng với oxit kim loại
- Hidro khử được nhiều oxit kim loại ở nhiệt độ cao.
Ví dụ: FeO + H2 → Fe + H2O
CuO + H2 → Cu + H2O
Nước:
Tính chất hóa học của nước
- Tác dụng với kim loại: nước có thể tác dụng với một số kim loại ở nhiệt độ thường như Ca, Ba, K,…
PTHH: K + H2O → KOH + H2
- Tác dụng với mốt sô oxit bazo như CaO, K2O,… tạo ra bazo tương ứng Ca(OH)2, KOH,…
- Dung dịch bazơ làm quỳ tím chuyển xanh
VD: K2O + H2O → 2KOH
- Tác dụng với oxit axit như SO3, P2O5,… tạo thành axit tương ứng H2SO4, H3PO4,…
- Dung dịch axit làm quỳ tím chuyển đỏ
VD: SO3 + H2O → H2SO4
Đúng 2
Bình luận (0)
nêu tính chất hóa học và mỗi tính chất viêt ví dụ một phương trình phản ứng của các chất:
a.oxi
b.hidro
c.nước
tc hóa học của oxi là
+t/c vs phi kim; vd 5O2 +4P --\(t^0\) ---> 2P2O5
+ t/c vs kim loại; Vd 2Mg +O2--\(t^0\) --> 2MgO
+ tác dụng với hợp chất; vd: 2O2+ CH4--\(t^0\) ---> CO2 + 2H2O
tính chất hóa học của H
+ tác dụng vs oxi; vd 2H2 + O2--\(t^0\) ---> 2H2O
+ tác dụng vs 1 số oxit bazo; vd: H2 + HgO--\(t^0\) ---> H2O +Hg
t/c hóa học của nc
+ t/d vs kim loại: 2K + 2H2O ---> 2KOH +H2
+ t/d vs 1 số oxit bazo: Na2O + H2O---> 2NaOH
+ t/d vs 1 số oxit axit : SO2 + H2O---- > H2SO3
Đúng 2
Bình luận (0)
nêu tính chất hóa học và mỗi tính chất viêt ví dụ một phương trình phản ứng của các chất:
a.oxi
b.hidro
c.nước
nêu tính chất hóa học của oxi
-Oxi là một chất không màu, không mùi, ít tan trong nước.
- Oxi có khối lượng phân tử là 32 nên oxi nặng hơn không khí. - Oxi khi bị hóa lỏng ở nhiệt độ -1830C sẽ có màu xanh nhạt và có thể bị hút bởi nam châm.
Đúng 0
Bình luận (0)
Tính chất vật lí : Là chất khí, không màu, không mùi, ít tan trong nước, nặng hơn không khí.
Đúng 0
Bình luận (0)
Lấy các ví dụ để minh họa các chất sau đây đóng vai trò chất oxi hóa hay chất khử trong các phản ứng hóa học: S, H2S, SO2, H2SO3.
S vừa có tính khử và tính OXH
\(H_2+S^0\underrightarrow{t^0}H_2S^{-2}\) ( Chất OXH )
\(S^0+O_{^2}\underrightarrow{t^0}S^{+4}O_{_{ }2}\) ( Chất Khử )
H2S chỉ thể hiện tính khử
\(2H_2S^{-2}+O_2^0\underrightarrow{t^0}2S^0+2H_2O\) ( Chất khử )
\(\)SO2 vừa có tính khử và tính OXH
\(2H_2S+S^{+4}O_2\underrightarrow{t^0}3S+2H_2O\) ( Chất OXH )
\(SO_2+\dfrac{1}{2}O_2\underrightarrow{t^0}SO_3\) ( Chất khử )
H2SO3 vừa có tính khử và tính OXH :
\(H_2SO_3+2H_2S\underrightarrow{t^0}3S+3H_2O\) ( Chất OXH )
\(5H_2SO_3+2KMnO_4\rightarrow2H_2SO_4+K_2SO_4+2MnSO_4+3H_2O\) ( Chất Khử )
Đúng 2
Bình luận (1)
Trong phản ứng ở ví dụ 1, hãy chỉ ra chất khử, chất oxi hóa, quá trình khử, quá trình oxi hóa.
Al + O2 → Al2O3
Al0 → Al3+ + 3e (quá trình oxi hóa)
Al là chất nhường electron → chất khử.
O0 + 2e → O2- (quá trình khử)
O là chất nhận electron → chất oxi hóa.
Đúng 0
Bình luận (0)
Câu 1: Nêu tính chất hoá học của oxi, mỗi tính chất viết một phương trình hoá học minh hoạ. Câu 2: Nêu định nghĩa phản ứng hóa hợp, phản ứng phân hủy. Cho thí dụ minh họa. Câu 3: Nêu định nghĩa oxit, cách gọi tên oxit cho thí dụ minh họa.
Xem chi tiết
Câu 1:
+ Tác dụng với kim loại: O2 oxi hóa được hầu hết các kim loại trừ Ag, Au, Pt
+ Tác dụng với Hiđro, Phản ứng có thể gây nổ mạnh nếu tỉ lệ phản ứng O2:H2 = 1:2
+ Tác dụng với một số phi kim khác:
+ Tác dụng với một số hợp chất:
Câu 2:
+ Phản ứng hóa hợp là PƯHH trong đó có một chất mới được tạo thành từ hai hay nhiều chất ban đầu.
+ Phản ứng phân hủy là PƯHH trong đó có 2 hay nhiều chất được tạo thành từ một chất ban đầu.
Đúng 1
Bình luận (0)
Câu 2:
+ Phản ứng hóa hợp là PƯHH trong đó có một chất mới được tạo thành từ hai hay nhiều chất ban đầu.
+ Phản ứng phân hủy là PƯHH trong đó có 2 hay nhiều chất được tạo thành từ một chất ban đầu.
Đúng 1
Bình luận (0)
Câu 1:
+ Tác dụng với kim loại: O2 oxi hóa được hầu hết các kim loại trừ Ag, Au, Pt
+ Tác dụng với Hiđro, Phản ứng có thể gây nổ mạnh nếu tỉ lệ phản ứng O2:H2 = 1:2
+ Tác dụng với một số phi kim khác:
+ Tác dụng với một số hợp chất:
Đúng 0
Bình luận (0)
Xem thêm câu trả lời