Những câu hỏi liên quan
Cho 6,72(lít) khí H2 phản ứng với 8,96(lít) khí O2(các thể tích khí đo ở điều kiện tiêu chuẩn)
a) Sau phản ứng chất nào hết, chất nào dư, tính khối lượng chất dư?
b) Tính số phân tử H2O tạo ra sau phản ứng
c) Khối lượng O2 tham gia vào phản ứng trên được điều chế từ KMnO4 hãy tính khối lượng KMnO4 cần dùng
\(a,n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\\ n_{O_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
PTHH: \(2H_2+O_2\underrightarrow{t^o}2H_2O\)
bđ 0,3 0,4
pư 0,3 0,15
sau pư 0 0,25 0,3
=> H2 hết, O2 dư
\(m_{O_2\left(dư\right)}=0,25.32=8\left(g\right)\)
b) \(A_{H_2O}=0,3.6.10^{23}=1,8.10^{23}\left(phân.tử\right)\)
c) \(m_{O_2\left(pư\right)}=0,15.32=4,8\left(g\right)\)
PTHH: \(2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\)
0,3<-------------------------------------0,15
\(\rightarrow m_{KMnO_4}=0,3.158=47,4\left(g\right)\)
Đúng 2
Bình luận (0)
Cho 3,6 gam Mg vào 140 ml dung dịch H2SO4 1,2M có khí thoát ra.
a) Viết phương trình phản ứng xảy ra.
b) Chất nào còn dư và dư bao nhiêu gam?
c) Tính khối lượng muối tạo thành.
d) Tính thể tích khí thu được ở điều kiện tiêu chuẩn.
\(a/ Mg+H_2SO_4 \to MgSO_4+H_2\\ b/ n_{Mg}=\frac{3,6}{24}=0,15(mol)\\ n_{H_2SO_4}=0,168(mol)\\ b/\\ Mg \text{ hết}; H_2SO_4 \text{ dư}\\ n_{H_2SO_4(dư)}=0,168-0,15=0,018(mol)\\ m_{H_2SO_4}=0,018.98=1,764(g)\\ c/\\ n_{MgSO_4}=0,15(mol)\\ m_{MgSO_4}=0,15.120=18(g)\\ d/\\ n_{H_2}=0,15\\ V=0,15.22,4=3,36(l)\)
Đúng 1
Bình luận (0)
Trộn 6,1975 lít khí H2 và 6,1975 lít khí O2 rồi đốt cháy
a) Sau phản ứng chất nào còn dư? Tính thể tích dư là bao nhiêu ?
b) Tính khối lượng nước tạo thành
c) Đê có 6,1975 lít khí O2 trên cân phân hủy bao nhiêu gam KClO3? Biết các thể tích khí trên được đo ở (đkc)
a, PT: \(2H_2+O_2\underrightarrow{t^o}2H_2O\)
Ta có: \(n_{H_2}=n_{O_2}=\dfrac{6,1975}{24,79}=0,25\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,25}{2}< \dfrac{0,25}{1}\), ta được O2 dư.
Theo PT: \(n_{O_2\left(pư\right)}=\dfrac{1}{2}n_{H_2}=0,125\left(mol\right)\)
\(\Rightarrow n_{O_2\left(dư\right)}=0,25-0,125=0,125\left(mol\right)\)
\(\Rightarrow V_{O_2\left(dư\right)}=0,125.24,79=3,09875\left(l\right)\)
b, Theo PT: \(n_{H_2O}=n_{H_2}=0,25\left(mol\right)\)
\(\Rightarrow m_{H_2O}=0,25.18=4,5\left(g\right)\)
c, PT: \(2KClO_3\underrightarrow{t^o}2KCl+3O_2\)
Theo PT: \(n_{KClO_3}=\dfrac{2}{3}n_{O_2}=\dfrac{1}{6}\left(mol\right)\)
\(\Rightarrow m_{KClO_3}=\dfrac{1}{6}.122,5\approx20,42\left(g\right)\)
Đúng 1
Bình luận (0)
Cho 5,6g sắt vào 100ml dụng dịch HCl 1M. Hãy: A) tính lượng khí h2 tạo ra ở điều kiện tiêu chuẩn? B) chất nào còn dư sau phản ứng và lượng dư là bao nhiêu? C) tính nồng độ các chất sau phản ứng?
a, \(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
\(n_{HCl}=0,1.1=0,1\left(mol\right)\)
PT: \(Fe+2HCl\rightarrow FeCl_2+H_2\)
Xét tỉ lệ: \(\dfrac{0,1}{1}>\dfrac{0,1}{2}\), ta được Fe dư.
Theo PT: \(n_{H_2}=\dfrac{1}{2}n_{HCl}=0,05\left(mol\right)\Rightarrow V_{H_2}=0,05.22,4=1,12\left(l\right)\)
b, Fe dư.
Theo PT: \(n_{Fe\left(pư\right)}=\dfrac{1}{2}n_{HCl}=0,05\left(mol\right)\Rightarrow n_{Fe\left(dư\right)}=0,1-0,05=0,05\left(mol\right)\)
\(\Rightarrow m_{Fe\left(dư\right)}=0,05.56=2,8\left(g\right)\)
c, \(n_{FeCl_2}=\dfrac{1}{2}n_{HCl}=0,05\left(mol\right)\Rightarrow C_{M_{HCl}}=\dfrac{0,05}{0,1}=0,5\left(M\right)\)
Đúng 1
Bình luận (0)
\(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
\(n_{HCl}=0,1.1=0,1\left(mol\right)\)
PTHH :
\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
trc p/u : 0,1 0,1
p/u : 0,05 0,1 0,05 0,05
sau p/u: 0,05 0 0,05 0,05
---> sau p/ư : Fe dư
\(a,V_{H_2}=0,05.22,4=1,12\left(l\right)\)
b, \(m_{Fedư}=0,05.56=2,8\left(g\right)\)
\(c,_{FeCl_2}=0,05.127=6,35\left(g\right)\)
\(m_{ddFeCl_2}=5,6+\left(0,1.36,5\right)-\left(0,05.1\right)=9,2\left(g\right)\)
\(C\%_{FeCl_2}=\dfrac{6,35}{9,2}.100\%\approx69\%\)
Đúng 0
Bình luận (0)
Cho 10,8 gam Al tác dụng hết với dung dịch HCl. Hãy cho biết;
a) Thể tích khí H2 sinh ra ở điều kiện tiêu chuẩn.
b) Tính khối lượng muối tạo thành.
c) Nếu dùng thể tích H2 trên để khử 16 gam CuO thì sau phản ứng chất nào còn dư và dư bao nhiêu gam ? Tính khối lượng Cu sinh ra.
a)
n Al = 10,8/27 = 0,4(mol)
2Al + 6HCl → 2AlCl3 + 3H2
n H2 = \(\dfrac{3}{2}\)n Al = 0,6(mol)
=> V H2 = 0,6.22,4 = 13,44(lít)
b) n AlCl3 = n Al = 0,4(mol)
=> m AlCl3 = 0,4.133,5 = 53,4(gam)
c) n CuO = 16/80 = 0,2(mol)
CuO + H2 \(\xrightarrow{t^o}\) Cu + H2O
n CuO = 0,2 < n H2 = 0,6 => H2 dư
n H2 pư = n Cu = n CuO = 0,2 mol
Suy ra:
m H2 dư = (0,6 -0,2).2 = 0,8(gam)
m Cu = 0,2.64 = 12,8(gam)
Đúng 1
Bình luận (0)
a) nAl=0,4(mol)
PTHH: 2Al + 6HCl -> 2AlCl3 + 3H2
nH2= 3/2 . nAl=3/2 . 0,4=0,6(mol)
=>V(H2,đktc)=0,6 x 22,4= 13,44(l)
b) nAlCl3= nAl=0,4(mol)
=>mAlCl3=133,5 x 0,4= 53,4(g)
c) nCuO=0,2(mol)
PTHH: CuO + H2 -to-> Cu + H2O
Ta có: 0,2/1 < 0,6/1
=> H2 dư, CuO hết, tính theo nCuO
=> nH2(p.ứ)=nCu=nCuO=0,2(mol)
=>nH2(dư)=0,6 - 0,2=0,4(mol)
=> mH2(dư)=0,4. 2=0,8(g)
mCu=0,2.64=12,4(g)
Đúng 0
Bình luận (0)
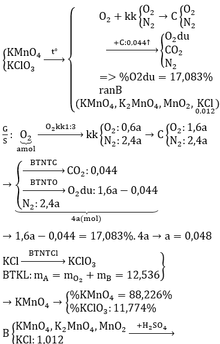
Nung m gam hỗn hợp A gồm KMnO4 và KClO3 thu được chất rắn B và khí O2. Lúc đó KClO3 phân hủy hoàn toàn, còn KMnO4 phân hủy không hoàn toàn. Trong B có 0,894 gam KCl chiếm 8,132% khối lượng. Trộn lượng O2 thu được ở trên với không khí (có phần trăm thể tích: 20% O2; 80% N2) theo tỉ lệ thể tích tương ứng là 1:3 tạo thành hỗn hợp khí C. Cho toàn bộ khí C vào bình chứa 0,528 gam cacbon rồi đốt cháy hết cacbon thu được hỗn hợp khí D gồm 3 khí trong đó O2 chiếm 17,083% về thể tích. a) Tính phần trăm k...
Đọc tiếp
Nung m gam hỗn hợp A gồm KMnO4 và KClO3 thu được chất rắn B và khí O2. Lúc đó KClO3 phân hủy hoàn toàn, còn KMnO4 phân hủy không hoàn toàn. Trong B có 0,894 gam KCl chiếm 8,132% khối lượng. Trộn lượng O2 thu được ở trên với không khí (có phần trăm thể tích: 20% O2; 80% N2) theo tỉ lệ thể tích tương ứng là 1:3 tạo thành hỗn hợp khí C. Cho toàn bộ khí C vào bình chứa 0,528 gam cacbon rồi đốt cháy hết cacbon thu được hỗn hợp khí D gồm 3 khí trong đó O2 chiếm 17,083% về thể tích.
a) Tính phần trăm khối lượng mỗi chất có trong A.
b) Thêm 74,5 gam KCl vào chất rắn B được hỗn hợp E. Cho E vào dung dịch H2SO4 loãng dư, đun nóng nhẹ cho đến phản ứng hoàn toàn. Tính thể tích khí thoát ra ở điều kiện tiêu chuẩn.
Đốt cháy 11,2 gam sắt trong 12,8 gam oxi sau phản ứng thu được sản phẩm là oxit sắt từ Fe3O4 Sau phản ứng chất nào còn dư và dư bao nhiêu mol? Tính khối lượng sản phẩm thu được Tính V không khí cần dùng ở điều kiện tiêu chuẩn? Biết O2 chiếm 1/5 thể tích không khí
PTHH: \(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
Ta có: \(\left\{{}\begin{matrix}n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\\n_{O_2}=\dfrac{12,8}{32}=0,4\left(mol\right)\end{matrix}\right.\)
Xét tỉ lệ: \(\dfrac{0,2}{3}< \dfrac{0,4}{2}\) \(\Rightarrow\) Oxi còn dư, Fe p/ứ hết
\(\Rightarrow n_{O_2\left(dư\right)}=0,4-\dfrac{2}{15}=\dfrac{4}{15}\left(mol\right)\)
+) Theo PTHH: \(\left\{{}\begin{matrix}n_{O_2}=\dfrac{2}{15}\left(mol\right)\\n_{Fe_3O_4}=\dfrac{1}{15}\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}V_{kk}=\dfrac{2}{15}\cdot22,4\cdot5\approx14,93\left(l\right)\\m_{Fe_3O_4}=\dfrac{1}{15}\cdot232\approx15,47\left(g\right)\end{matrix}\right.\)
Đúng 1
Bình luận (0)
Cho 3,36 lit khí H2 tác dụng với 1,12 lit khí O2( các thể tích đo ở đktc). Sau phản ứng thu được sản phẩm là H2O.
a) Chất nào còn dư? Dư bao nhiêu lit?
b) Tính khối lượng H2O thu được.
a, Theo gt ta có: $n_{H_2}=0,15(mol);n_{O_2}=0,05(mol)$
$2H_2+O_2\rightarrow 2H_2O$
Sau phản ứng $H_2$ còn dư. Và dư 0,05.22,4=1,12(l)
b, Ta có: $n_{H_2O}=2.n_{O_2}=0,1(mol)\Rightarrow m_{H_2O}=1,8(g)$
Đúng 3
Bình luận (0)
nH2 = 3.36/22.4 = 0.15 (mol)
nO2 = 1.12/22.4 = 0.05 (mol)
2H2 + O2 -to-> 2H2O
0.1___0.05_____0.1
VH2 (dư) = ( 0.15 - 0.1) * 22.4 = 1.12 (l)
mH2O = 0.1*18 = 1.8 (g)
Đúng 2
Bình luận (0)
Cho 32,5g Zn tác dụng với 3,65g axít clohidric(HCL), thu được kẽm clorica(ZnCl2) và khíH2
a/ viết pthh
b/cho biết chất nào còn dư,dư bao nhiêu g sau phản ứng
c/ tính khối lượng Fe3O4 thu được
d/ tính thể tích khí H2 thu được ở điều kiện tiêu chuẩn
Xem chi tiết
a) PTHH: \(Zn+2HCl\rightarrow ZnCl_2+H_2\uparrow\)
b) Ta có: \(\left\{{}\begin{matrix}n_{Zn}=\dfrac{32,5}{65}=0,5\left(mol\right)\\n_{HCl}=\dfrac{3,65}{36,5}=0,1\left(mol\right)\end{matrix}\right.\)
Xét tỉ lệ: \(\dfrac{0,5}{1}>\dfrac{0,1}{2}\) \(\Rightarrow\) HCl phản ứng hết, Zn còn dư
\(\Rightarrow n_{Zn\left(dư\right)}=0,5-0,05=0,45\left(mol\right)\) \(\Rightarrow m_{Zn\left(dư\right)}=0,45\cdot65=29,25\left(g\right)\)
c+d) Theo PTHH: \(n_{ZnCl_2}=n_{H_2}=\dfrac{1}{2}n_{HCl}=0,05mol\)
\(\Rightarrow\left\{{}\begin{matrix}m_{ZnCl_2}=0,05\cdot136=6,8\left(g\right)\\V_{H_2}=0,05\cdot22,4=1,12\left(l\right)\end{matrix}\right.\)
Đúng 2
Bình luận (0)