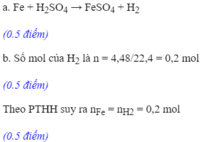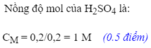Cho một khối lượng bột sắt tác dụng vừa đủ với 500 ml dung dịch axit clohiđric có nồng độ 0,2 M a) viết phương trình phản ứng b) xác định khối lượng của sắt đã tham gia phản ứng c) tính khối lượng muối thu được sau phản ứng

Những câu hỏi liên quan
Cho 1 khối lượng một sắt tác dụng vừa đủ với 500ml đúng dịch HCl có nồng độ 0,2 M a, Viết phương trình b, Xác định khối lượng bột sắt đã tham gia phản ứng c, Tính khối lượng muối thu được sau phản ứng
nHCl=0,2.0,5=0,1(mol)
a,Fe+2HCl→FeCl2+H2
⇒nFe=nFeCl2=1/2nHCl=0,05(mol)
b,mFe=0,05.56=2,8(g)
c,mFeCl2=0,05.127=6,35(g)
Đúng 0
Bình luận (0)
Cho a gam sắt tác dụng vừa đủ với 500ml dung dịch axit clohiđric có nồng độ 0,2M a; viết phương trình phản ứng b; Xác định a c; tính thể tích khí hiđro ở đktc d; tính khối lượng muối thu được sau phản ứng
500ml = 0,5l
\(n_{HCl}=0,2.0,5=0,1\left(mol\right)\)
a) Pt : \(Fe+2HCl\rightarrow FeCl_2+H_2|\)
1 2 1 1
0,05 0,1 0,05 0,05
b) \(n_{Fe}=\dfrac{0,1.1}{2}=0,05\left(mol\right)\)
⇒ \(m_{Fe}=0,05.56=2,8\left(g\right)\)
c) \(n_{H2}=\dfrac{0,1.1}{2}=0,05\left(mol\right)\)
\(V_{H2\left(dktc\right)}=0,05.22,4=1,12\left(l\right)\)
d) \(n_{FeCl2}=\dfrac{0,05.1}{1}=0,05\left(mol\right)\)
⇒ \(m_{FeCl2}=0,05.127=6,35\left(g\right)\)
Chúc bạn học tốt
Đúng 5
Bình luận (0)
nHCl = 0,5.0,2= 0,1(mol)
a) Fe + 2HCl → FeCl2+ H2
0,05 ← 0,1 → 0,05 →0,05
b) mFe = 0,05.56=2,8(gam)
c) VH2= 0,05 .22,4 =1,12 (lít)
d) mFeCl2 = 0,05.(56+35,5.2)=6,35(gam)
Đúng 0
Bình luận (0)
cho sắt tác dụng vừa đủ với 300 ml dung dịch HCl. sau phản ứng thu được 4,958 lít khí H2 ở điều kiện chuẩn a) viết phương trình hóa học b) tính khối lượng sắt tham gia phản ứng c) tính nồng độ mol của HCl đã dùng ( cíu em với ạ TT)
cho một lượng bột nhôm đủ phản ứng với 200ml dung dịch axit clohiđric thu được 1,12l hiđro(đktc)
a. Viết phương trình phản ứng
b. Tính khối lượng Al tham gia phản ứng
c. Tính nồng độ mol dung dịch axit clohiđric đã dùng
\(a)\ 2Al + 3H_2SO_4 \to Al_2(SO_4)_3 + 3H_2\)
\(b)\ n_{H_2} = \dfrac{1,12}{22,4} = 0,05(mol)\\ n_{Al} = \dfrac{2}{3}n_{H_2} = \dfrac{0,1}{3}(mol)\\ \Rightarrow m_{Al} = \dfrac{0,1}{3}.27= 0,9\ gam\)
\(c)\ n_{HCl} = 2n_{H_2} = 0,05.2 = 0,1(mol)\\ \Rightarrow C_{M_{HCl}} = \dfrac{0,1}{0,2} = 0,5M\)
Đúng 1
Bình luận (0)
a) PTHH: \(2Al+6HCl\rightarrow2AlCl_3+3H_2\uparrow\)
b) Ta có: \(n_{H_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
\(\Rightarrow n_{Al}=\dfrac{1}{30}\left(mol\right)\) \(\Rightarrow m_{Al}=\dfrac{1}{30}\cdot27=0,9\left(g\right)\)
b) Theo PTHH: \(n_{HCl}=2n_{H_2}=0,1\left(mol\right)\)
\(\Rightarrow C_{M_{HCl}}=\dfrac{0,1}{0,2}=0,5\left(M\right)\)
Đúng 1
Bình luận (0)
Cho một lượng bột sắt dư vào 200ml dung dịch axit H 2 S O 4 . Phản ứng xong thu được 4,48 lít khí hiđrô (đktc)
a. Viết phương trình phản ứng hoá học
b. Tính khối lượng sắt đã tham gia phản ứng
c. Tính nồng độ mol của dung dịch axit H 2 S O 4 đã dùng
Bài 2: Cho một lượng bột sắt vào dung dịch axit clohiđric HCl, phản ứng xong thu được 3,36 lít khí H2 ở đktc.
a) Tính khối lượng sắt đã tham gia phản ứng
b) Tính khối lượng dung dịch HCl 16% cần dùng cho phản ứng.
a) $Fe +2HCl \to FeCl_2 + H_2$
Theo PTHH : $n_{Fe} = n_{H_2} = \dfrac{3,36}{22,4} = 0,15(mol)$
$m_{Fe} = 0,15.56 = 8,4(gam)$
b) $n_{HCl} = 2n_{H_2} = 0,3(mol)$
$\Rightarrow m_{dd\ HCl} = \dfrac{0,3.36,5}{16\%} = 68,4375(gam)$
Đúng 0
Bình luận (0)
Bài 2: Cho một lượng bột sắt vào dung dịch axit clohiđric HCl, phản ứng xong thu được 3,36 lít khí H2 ở đktc.
a) Tính khối lượng sắt đã tham gia phản ứng
b) Tính khối lượng dung dịch HCl 16% cần dùng cho phản ứng.
a) `n_{H_2} = (3,36)/(22,4) = 0,15 (mol)`
PTHH: `Fe + 2HCl -> FeCl_2 + H_2`
Theo PT: `n_{Fe} = n_{H_2} = 0,15 (mol)`
`=> m_{Fe} = 0,15.56 = 8,4 (g)`
b) Theo PT: `n_{HCl} = 2n_{H_2} = 0,3 (mol)`
`=> m_{ddHCl} = (0,3.36,5)/(16\%) = 68,4375 (g)`
Đúng 0
Bình luận (0)
cho 5,6 gam sắt tác dụng với axit clohiđric. tính khối lượng axit hcl tham gia phản ứng. vẫn dùng lượng sắt như trên tác dụng với 400ml dung dịch hcl nồng độ im chất nào còng dư sau phản ứng , lượng dư là bao nhiêu mol
Đề cho lượng 1 chất sao lại hỏi dư hay k
Đúng 0
Bình luận (0)
Câu 1: Cho một lương bột sắt dư vào trong 100ml dung dịch H2SO4. Phản ứng xong thu được 6,72 lít khí hidro(đktc)a) Viết phương trình phản ứng xảy rab) Tính khối lượng bột sắt tham gia phản ứngc) Tính nồng độ mol của dung dịch axit tham gia phản ứngd) Dẫn lượng khí sinh ra qua CuO có nhiệt độ tham gia, tính khối lượng chất rắn tạo thànhCâu 2: Cho 14 gam Fe tác dụng vừa đủ với 400 gam dung dịch axit sunfuric H2SO4 loãng thấy có khí thoát ra(đktc)a) Viết phương trình phản ứngb) Tính khối lượng muối...
Đọc tiếp
Câu 1: Cho một lương bột sắt dư vào trong 100ml dung dịch H2SO4. Phản ứng xong thu được 6,72 lít khí hidro(đktc)
a) Viết phương trình phản ứng xảy ra
b) Tính khối lượng bột sắt tham gia phản ứng
c) Tính nồng độ mol của dung dịch axit tham gia phản ứng
d) Dẫn lượng khí sinh ra qua CuO có nhiệt độ tham gia, tính khối lượng chất rắn tạo thành
Câu 2: Cho 14 gam Fe tác dụng vừa đủ với 400 gam dung dịch axit sunfuric H2SO4 loãng thấy có khí thoát ra(đktc)
a) Viết phương trình phản ứng
b) Tính khối lượng muối thu được?
c) Tính thể tích khí sinh ra? (đktc)
d) Tính nồng độ phần trăm dung dịch sau phản ứng
Fe+2HCl->FeCl2+H2
0,3----0,6--0,3------0,3
n H2=0,3 mol
=>m Fe=0,3.56=16.8g
=>CM=0,6\0,1=6M
CuO+H2-tO>Cu+H2O
0.3---------------0,3
=>m Cu=0,3.64=19,2g
Đúng 3
Bình luận (0)
câu 2
FE+H2SO4->FeSO4+H2
0,25----0,25----0,25---0,25
n Fe=0,25 mol
=>mFeCl2=0,25.127=31,75g
=>VH2=0,25.22,4=5,6l
=>C% muối=\(\dfrac{31,75}{14+400-0,25.2}100=7,67\%\)
Đúng 3
Bình luận (0)