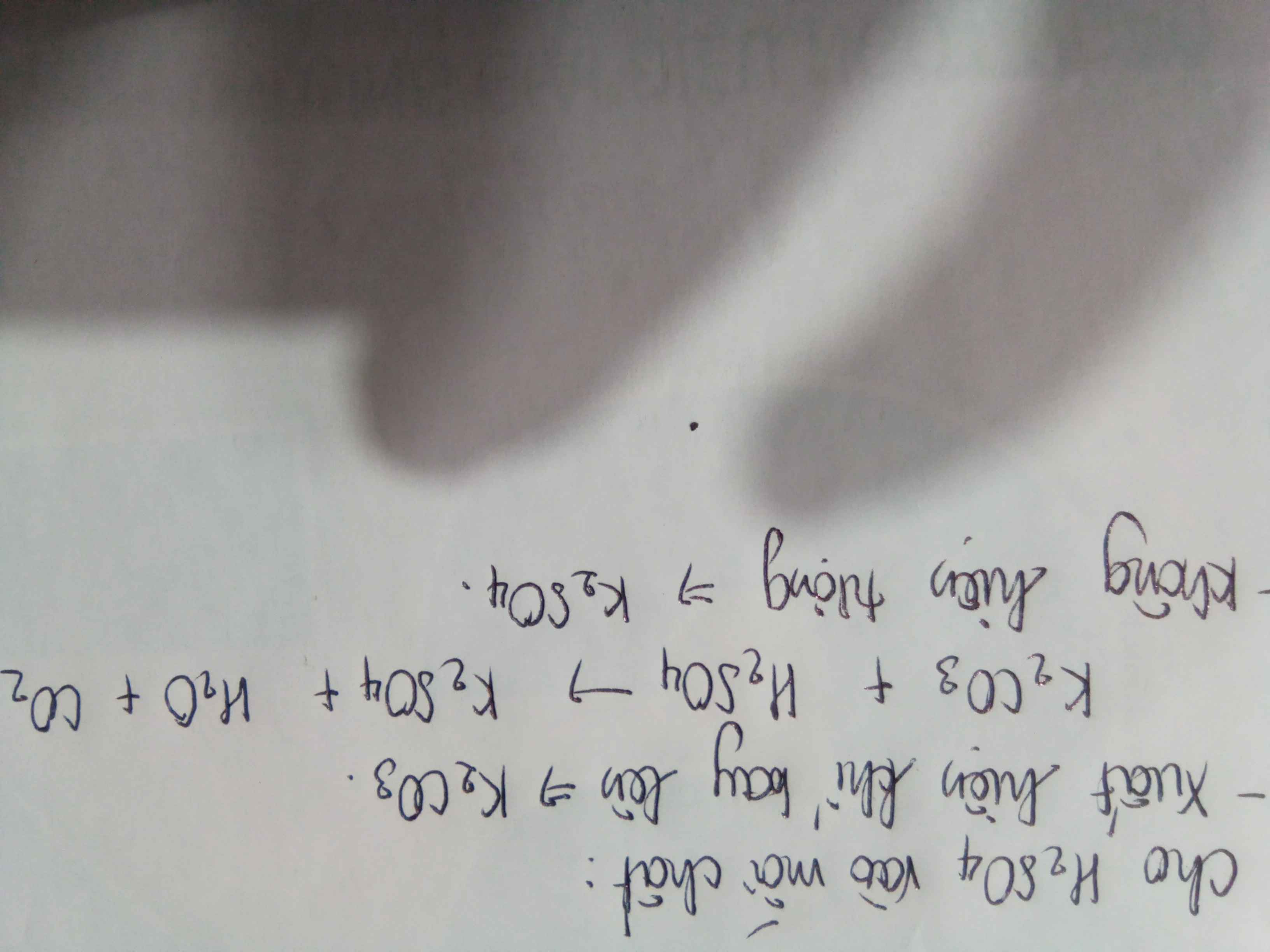tính số mol của K2CO3 và K2SO4 trong 150g dd hh gồm K2CO3 13,8% và K2SO4 34,8%

Những câu hỏi liên quan
Cho 3 bình đựng các dung dịch mất nhãn là X gồm (KHCO3 và K2CO3), Y gồm (KHCO3 và K2SO4), Z gồm (K2CO3 và K2SO4). Để nhận biết được X, Y, Z, cần dùng 2 dung dịch là: A. Ba(OH)2 và HCl B. HCl và BaCl2 C. BaCl2 và H2SO4 D. H2SO4 và Ba(OH)2
Đọc tiếp
Cho 3 bình đựng các dung dịch mất nhãn là X gồm (KHCO3 và K2CO3), Y gồm (KHCO3 và K2SO4), Z gồm (K2CO3 và K2SO4). Để nhận biết được X, Y, Z, cần dùng 2 dung dịch là:
A. Ba(OH)2 và HCl
B. HCl và BaCl2
C. BaCl2 và H2SO4
D. H2SO4 và Ba(OH)2
hòa tan 3,04 g hh FeO và Fe2O3 vào dd H2SO4 loãng dư thu dc dd A,dd A làm mất màu vừa hết 15,8 g K2SO4,tính tỉ lẹ % về số mol FeO và Fe3O4 trong hh
Câu 8. Cặp chất nào sau đây phản ứng được với nhau? A. dd Na2SO4 và dd K2CO3 B. dd BaCl2 và dd FeSO4 C. dd NaCl và dd K2SO4 D. dd BaCl2 và dd Cu(NO3)2Câu 9. Khi cho dung dịch BaCl2 vào dung dịch Na2SO4 ta thấy hiện tượngA. Có khí mùi hắc bay lên.B. Có khí không màu bay lên, dung dịch nhạt màu dần.C. Có kết tủa trắng xuất hiện.D. Không có hiện tượng gì.Câu 10. Cho dãy các oxit sau: FeO, CaO, CuO, K2O, BaO, CaO,...
Đọc tiếp
Câu 8. Cặp chất nào sau đây phản ứng được với nhau?
A. dd Na2SO4 và dd K2CO3 B. dd BaCl2 và dd FeSO4
C. dd NaCl và dd K2SO4 D. dd BaCl2 và dd Cu(NO3)2
Câu 9. Khi cho dung dịch BaCl2 vào dung dịch Na2SO4 ta thấy hiện tượng
A. Có khí mùi hắc bay lên.
B. Có khí không màu bay lên, dung dịch nhạt màu dần.
C. Có kết tủa trắng xuất hiện.
D. Không có hiện tượng gì.
Câu 10. Cho dãy các oxit sau: FeO, CaO, CuO, K2O, BaO, CaO, Li2O, Ag2O. Số chất tác dụng được vơi H2O tạo thành dung dịch bazơ?
A. 1 B. 3 C. 4 D. 5
Câu 11. Cho các oxit sau: K2O, CO, SO2, CaO, CO2, Al2O3. Số cặp chất tác dụng được với nhau?
A. 5 B. 3 C. 4 D. 2
Câu 12. Có thể dùng chất nào dưới đây làm khô khí O2 có lẫn hơi nước
A. SO3 B. SO2
C. CuO D. P2O5
C8: B
\(BaCl_2+FeSO_4\rightarrow FeCl_2+BaSO_{4\downarrow}\)
C9: C
\(BaCl_2+Na_2SO_4\rightarrow2NaCl+BaSO_{4\downarrow}\)
C10: C
CaO, K2O, BaO, Li2O
PT: \(CaO+H_2O\rightarrow Ca\left(OH\right)_2\)
\(K_2O+H_2O\rightarrow2KOH\)
\(BaO+H_2O\rightarrow Ba\left(OH\right)_2\)
\(Li_2O+H_2O\rightarrow2LiOH\)
C11: C
\(K_2O+SO_2\rightarrow K_2SO_3\)
\(K_2O+CO_2\rightarrow K_2CO_3\)
\(SO_2+CaO\rightarrow CaSO_3\)
\(CaO+CO_2\rightarrow CaCO_3\)
C12: D
Đúng 3
Bình luận (0)
Có 3 lọ bị mất nhãn,mỗi lọ chứa 1 hỗn hợp dung dịch:(K2CO3 và NaHCO3);(KHCO3 và Na2SO4);(Na2CO3 và K2SO4).Chỉ dùng dd BaCl2 và dd HCl,nêu cách nhận biết các lọ.
Nhỏ từ từ $HCl$ vào 3 mẫu thử. Lọ nào không xuất hiện khí ngay chứa $Na_2CO_3$ và $K_2SO_4$. Hai lọ còn lại tạo khí ngay lập tức
Nhỏ $BaCl_2$ vào hai lọ còn lại tới khi thấy kết tủa không tăng thì đem nhỏ $HCl$ tới dư. Lọ nào vẫn cho kết tủa thì chứa $KHCO_3$ và $Na_2SO_4$
Lọ còn lại chứa $K_2CO_3$ và $NaHCO_3$
Đúng 4
Bình luận (1)
Trích mẫu thử
Cho từ từ dd HCl vào mẫu thử
- MT xuất hiện khí ngay là $KHCO_3$ và $Na_2SO_4$
- MT sau một thời gian mới xuất hiện khí là $K_2CO_3$ và $NaHCO_3$ ; $Na_2CO_3$ và $K_2SO_4$
Cho dung dịch $BaCl_2$ tới dư vào hai mẫu thử còn. Sau đó thêm lượng dư dung dịch $HCl$
- MT nào tạo kết tủa rồi tan hết là $K_2CO_3,NaHCO_3$
- MT nào không tan hoàn toàn là $Na_2CO_3,K_2SO_4$
$K_2CO_3 + HCl \to KCl + KHCO_3$
$NaHCO_3 + HCl \to NaCl + CO_2 + H_2O$
$KHCO_3 + HCl \to KCl + CO_2 + H_2O$
$Na_2CO_3 + HCl \to NaCl + NaHCO_3$
$BaCl_2 +K_2CO_3 \to BaCO_3 + 2KCl$
$BaCl_2 + K_2SO_4 \to BaSO_4 + 2KCl$
$BaCO_3 + 2HCl \to BaCl_2 + CO_2 + H_2O$
Đúng 3
Bình luận (1)
chất nào có thể phân biệt k2co3 và k2so4
Nhận biết K2CO3, K2SO4, KCl, K2SO4
Trích mỗi chất một ít ra ống nghiệm làm thuốc thử:
Cho dd HCl vào từng mẫu thử:
- Sủi bọt: K2CO3
Hai mẫu thử còn lại cho dd Ba(OH)2 vào:
+ Kết tủa trắng: K2SO4
+ không hiện tượng: KCl
PTHH tự viết
Đúng 0
Bình luận (0)
Lấy mẫu thử và đánh dấu từng mẫu thử
Cho dung dịch H2SO4 vào các mẫu thử
K2CO3 + H2SO4 => K2SO4 + CO2 + H2O
Mẫu thử xuất hiện khí thoát ra là K2CO3
Cho dung dịch AgNO3 vào các mẫu thử
AgNO3 + KCl => AgCl + KNO3
Mẫu thử xuất hiện kết tủa trắng là KCl
Còn lại là dung dịch K2SO4
Đúng 0
Bình luận (0)
Trộn V(ml) dd K2CO3 10% (D=1,25) với 150g dd K2CO3 4% được dd K2CO3 6,4%.Tính V
Trong V ml dung dịch $K_2CO_3$ 10% có D = 1,25(g/ml), ta có :
$m_{dd} = 1,25V(gam)$
$m_{K_2CO_3} = 1,25V.10\% = 0,125V(gam)$
Sau khi trộn :
$m_{dd} = 1,25V + 150(gam)$
$m_{K_2CO_3} = 0,125V + 150.4\% = 0,125V + 6(gam)$
Suy ra :
$\dfrac{0,125V + 6}{1,25V + 150} = \dfrac{6,4}{100}$
$\Rightarrow V = 80(ml)$
Đúng 2
Bình luận (0)
Câu 2:nhận biết
a)NaF,NaCl,NaBr,NaI
b)NaCl,Na2SO4,NaBr,NaNO3
c)K2CO3,KCL,K2SO4,KI
d)BaCl2,Na2S, K2SO4,NaBr
e) K2SO4,FeCl2,CaCl2,KNO3
f)Al2(SO4)3,,KCL,Fe(NO3)3,NaI
g) K2CO3,KNO3,KBr,KI
h)Fe2(SO4)3, K2SO4,Na2CO3,NaNO3
a, _ Trích mẫu thử.
_ Nhỏ một lượng từng mẫu thử vào ống nghiệm chứa dd AgNO3.
+ Nếu xuất hiện kết tủa trắng, đó là NaCl.
PT: \(NaCl+AgNO_3\rightarrow AgCl_{\downarrow}+NaNO_3\)
+ Nếu xuất hiện kết tủa vàng nhạt, đó là NaBr.
PT: \(NaBr+AgNO_3\rightarrow NaNO_3+AgBr_{\downarrow}\)
+ Nếu xuất hiện kết tủa vàng đậm, đó là NaI.
PT: \(NaI+AgNO_3\rightarrow NaNO_3+AgI_{\downarrow}\)
+ Nếu không có hiện tượng, đó là NaF.
_ Dán nhãn.
b, _ Trích mẫu thử.
_ Nhỏ một lượng từng mẫu thử vào ống nghiệm chứa dd BaCl2.
+ Nếu xuất hiện kết tủa trắng, đó là Na2SO4.
PT: \(Na_2SO_4+BaCl_2\rightarrow2NaCl+BaSO_{4\downarrow}\)
+ Nếu không có hiện tượng, đó là NaCl, NaBr và NaNO3 (1).
_ Nhỏ một lượng từng mẫu thử nhóm (1) vào ống nghiệm chứa dd AgNO3.
+ Nếu xuất hiện kết tủa trắng, đó là NaCl.
PT: \(NaCl+AgNO_3\rightarrow NaNO_3+AgCl_{\downarrow}\)
+ Nếu xuất hiện kết tủa vàng nhạt, đó là NaBr.
PT: \(NaBr+AgNO_3\rightarrow NaNO_3+AgBr_{\downarrow}\)
+ Nếu không có hiện tượng xảy ra, đó là NaNO3.
_ Dán nhãn.
c, _ Trích mẫu thử.
_ Nhỏ một lượng từng mẫu thử vào ống nghiệm chứa dd HCl.
+ Nếu có khí không màu thoát ra, đó là K2CO3.
PT: \(K_2CO_3+2HCl\rightarrow2KCl+H_2O+CO_2\uparrow\)
+ Nếu không có hiện tượng, đó là KCl, K2SO4. (1)
_ Nhỏ một lượng mẫu thử nhóm (1) vào ống nghiệm chứa dd BaCl2.
+ Nếu xuất hiện kết tủa trắng, đó là K2SO4.
PT: \(BaCl_2+K_2SO_4\rightarrow2KCl+BaSO_{4\downarrow}\)
+ Nếu không có hiện tượng xảy ra, đó là KCl.
_ Dán nhãn.
Bạn tham khảo nhé!
Đúng 1
Bình luận (1)
Để đơn giản và đỡ tốn thời gian thì từ những phần sau mình vẽ sơ đồ nhận biết, bạn có thể dựa trên đó để trình bày như các phần trên nhé!


Đúng 1
Bình luận (0)
Xem thêm câu trả lời
Bình X chứa dd KHCO3 cà K2CO3
Bình Y chứa dd KHCO3 và K2SO4
Bình Z chứa dd K2CO3 và K2SO4
-Chỉ dùng quỳ tím, dd HCl, dd Ba(OH)2 và ống nghiệm.Hãy nhận biết từng lọ trên, viết pthh
Cho dd Ba(OH)2 vào các mẫu thử ta thấy có kết tủa xuất hiện,sau đó cho dd HCl dư vào các kết tủa trên nhận ra:
+X tạo kết tủa chỉ có BaCO3 nên tác dụng với HCl dư tạo khí và kết tủa tan hết.
+Y,Z tạo kết tủa gồm BaCO3 và BaSO4 nên tác dụng với HCl dư vẫn còn BaSO4 ko tan.
Lấy dd ở trong bình Y,Z sau PƯ với Ba(OH)2,rồi cho quỳ tím vào nhận ra:
+Y quỳ tím hóa xanh(vì có dd K2CO3)
+Z quỳ tím ko chuyển màu
Đúng 1
Bình luận (0)
@Einstein@Trần Hữu Tuyển@Cẩm Vân Nguyễn Thị@phương mai.....
Đúng 0
Bình luận (2)
-Trích mẫu thử, cho các mẫu thử vào 3 ống nghiệm khác nhau, đánh sô thứ tự
- Cho dd Ba(OH)2 vào lần lượt các mẫu thử:
Cả 3 đều xuất hiện kết tủa trắng
PTHH: 2KHCO3 + Ba(OH)2-> BaCO3 + K2CO3+ 2 H2O
K2CO3 + Ba(OH)2-> BaCO3 + 2KOH
K2SO4 + Ba(OH)2-> BaSO4 +2 KOH
- Cho dd HCl đến dư vào mỗi lọ
+ lọ chứa kết tủa bị tan hết: ddKHCO3 và dd K2CO3=> bình X
PTHH: BaCO3 +2 HCl-> BaCl2 + H2O+ CO2
+ lọ chứa kết tủa bị tan 1 phần nhất định sau đó ko tan được nứa
=> 2 lọ: * 1 lọ chứa các dd của bình Y
* 1 lọ chứa các dd của binh Z
- Cho quỳ tím vào 2 lọ còn lại
+ Quỳ đổi màu xanh: lọ có chứa dd K2CO3
=> bình Z
+ Quỳ ko đổi màu: lọ chứa dd KHCO3 và dd K2SO4
=> Bình Y
Làm hơi dài thui kệ cũng đúng ko sao
Đúng 1
Bình luận (4)
Xem thêm câu trả lời