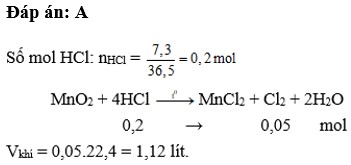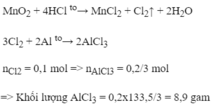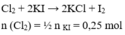Cho dung dịch acid có chứa 7.3gam HCL tác dụng với MnO2 dư. Thể tích khí clo(Đkc) sinh ra

Những câu hỏi liên quan
Cho dung dịch axit có chứa 7,3 gam HCl tác dụng với M n O 2 dư. Thể tích khí clo sinh ra (đktc) là
A. 1,12 lít
B. 2,24 lít
C. 11,2 lít
D. 22,4 lít
Cho dung dịch chứa 0,4 mol HCl tác dụng với M n O 2 (dư) thu được khí clo. Khí clo tạo ra phản ứng hết với nhôm. Tính khối lượng A l C l 3 thu được (Al=27, Cl=35,5).
cho MnO2 tác dụng với dung dịch HCl đặc thu được MnCl2,Cl2,H2O
a) tính thể tích Cl2 sinh ra khi cho 17,4g MnO2 tác dụng với dung dịch HCl dư
\(n_{MnO_2}=\dfrac{17,4}{87}=0,2\left(mol\right)\)
PTHH: MnO2 + 4HCl --> MnCl2 + Cl2 + 2H2O
______0,2------------------------->0,2
=> VCl2 = 0,2.22,4 = 4,48(l)
Đúng 1
Bình luận (0)
Cho dung dịch hydrochloric acid 0.8M tác dụng vừa đủ với 3,9g Zinc
a) tính thể tích khí sinh ra (đkc)
b) tính thể tích dung dịch acid đã dùng
c) tính nồng độ mol dung dịch muối thu được sau phản ứng?
Zn=65, H=1, Cl=35,5
\(a)n_{Zn}=\dfrac{3,9}{65}=0,06mol\\ Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,06 0,12 0,06 0,06
\(V_{H_2}=0,06.24,79=1,4874l\\ b)V_{HCl}=\dfrac{0,12}{0,8}=0,15l=150ml\)
\(C_M\)\(_{ZnCl_2}=\dfrac{0,06}{0,15}=0,4M\)
Đúng 1
Bình luận (0)
Câu 3 Cho 4.8 g Magnesium tác dụng với 300 ml dung dịch hydrochloric acid HCl thu được muối Magnesium chloride MgCl2 và khí hydrogen. a. Viết phương trình phản ứng b.Tính thể tích khí hydrogen sinh ra (ở đkc) c. Tính khối lượng muối Magnesium chloride MgCl2 thu được sau phản ứng d. Tính nồng độ mol của dung dịch hydrochloric acid HCl
Đọc tiếp
Câu 3
Cho 4.8 g Magnesium tác dụng với 300 ml dung dịch hydrochloric acid HCl thu được muối Magnesium chloride MgCl2 và khí hydrogen.
a. Viết phương trình phản ứng
b.Tính thể tích khí hydrogen sinh ra (ở đkc)
c. Tính khối lượng muối Magnesium chloride MgCl2 thu được sau phản ứng
d. Tính nồng độ mol của dung dịch hydrochloric acid HCl
\(a.Mg+2HCl\rightarrow MgCl_2+H_2\\ b.n_{Mg}=\dfrac{4,8}{24}=0,2mol\\ Mg+2HCl\rightarrow MgCl_2+H_2\)
0,2 0,4 0,2 0,2
\(V_{H_2}=0,2.24,79=4,958l\\ c.m_{MgCl_2}=0,2.95=19g\\ d.C_{M_{HCl}}=\dfrac{0,4}{0,3}=\dfrac{4}{3}M\)
Đúng 2
Bình luận (0)
a, nMg=0,2(mol)
Mg+2HCl=>MgCl2+H2
b, nH2=nMg=0,2(mol)
=>VH2=4,958(l)
c,nMgCl2=nMg=0,2(mol)
=>mMgCl2=19(g)
d,nHCl=2nMg=0,4(mol)
=>cM(HCl)=0,75(M)
Đúng 0
Bình luận (0)
Bài 3. Cho 10,44 (g) MnO 2 tác dụng axit HCl đặc. Khí sinh ra (đkc) cho tác dụng vừa đủ với dung dịch
NaOH 2 (M).
a. Tính thể tích khí sinh ra (đkc).
b. Tính thể tích dung dịch NaOH đã phản ứng và nồng độ (mol/l) các chất trong dung dịch thu được.
a)
$MnO_2 + 4HCl \to MnCl_2 + Cl_2 + 2H_2O$
Theo PTHH :
n Cl2 = n MnO2 = 10,44/87 = 0,12(mol)
=> V Cl2 = 0,12.22,4 = 2,688(lít)
b)
$2NaOH + Cl_2 \to NaCl + NaClO + H_2O$
n NaOH = 2n Cl2 = 0,24(mol)
=> V dd NaOH = 0,24/2 = 0,12(lít)
Đúng 2
Bình luận (0)
Cho 25 gam K M n O 4 (có a% tạp chất) tác dụng với dung dịch HCl dư thu được khí clo. Để khí clo sinh ra phản ứng vừa đủ với dung dịch chứa 83 gam KI tạo I 2 , giá trị của a là
A. 20
B. 59,25
C. 36,8
D. 26
Cho 69,6 gam MnO2 tác dụng với HCl đặc, dư.(H%90%). Dẫn toàn bộ lượng khí sinh ra vào 500 ml dung dịch NaOH 4M thu được dung dịch A. Thể tích khí Cl2 thu được ở đktc sau phản ứng là: A. 17,92 B. 16,128 C. 19,9 D. 13,44
Đọc tiếp
Cho 69,6 gam MnO2 tác dụng với HCl đặc, dư.(H%=90%). Dẫn toàn bộ lượng khí sinh ra vào 500 ml dung dịch NaOH 4M thu được dung dịch A. Thể tích khí Cl2 thu được ở đktc sau phản ứng là:
A. 17,92
B. 16,128
C. 19,9
D. 13,44
Bài 1. Cho 19,5g zinc tác dụng hết với dung dịch hydrochloric acid HCl
a. Tính thể tích khí H2 sinh ra (đkc)
b. Nếu dùng thể tích khí H2 trên để khử 19,2g iron (III) oxide thì thu được bao nhiêu game iron?
Bài 2. Cho 9,2g Na vào nước dư thì thu được NaOH và khí H2. Tính thể tích khí H2 (đkc) thoát ra và khối lượng NaOH tạo thành?
Bài 1:
a, \(n_{Zn}=\dfrac{19,5}{65}=0,3\left(mol\right)\)
PT: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
Theo PT: \(n_{H_2}=n_{Zn}=0,3\left(mol\right)\Rightarrow V_{H_2}=0,3.24,79=7,437\left(l\right)\)
b, \(n_{Fe_2O_3}=\dfrac{19,2}{160}=0,12\left(mol\right)\)
PT: \(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
Xét tỉ lệ: \(\dfrac{0,12}{1}>\dfrac{0,3}{3}\), ta được Fe2O3 dư.
Theo PT: \(n_{Fe}=\dfrac{2}{3}n_{H_2}=0,2\left(mol\right)\Rightarrow m_{Fe}=0,2.56=11,2\left(g\right)\)
Đúng 0
Bình luận (0)
Bài 2:
Ta có: \(n_{Na}=\dfrac{9,2}{23}=0,4\left(mol\right)\)
PT: \(2Na+2H_2O\rightarrow2NaOH+H_2\)
Theo PT: \(n_{H_2}=\dfrac{1}{2}n_{Na}=0,2\left(mol\right)\Rightarrow V_{H_2}=0,2.24,79=4,958\left(l\right)\)
\(n_{NaOH}=n_{Na}=0,4\left(mol\right)\Rightarrow m_{NaOH}=0,4.40=16\left(g\right)\)
Đúng 0
Bình luận (1)