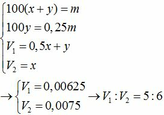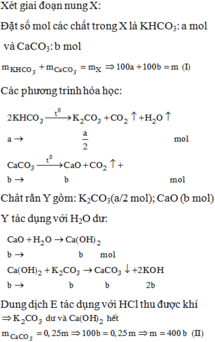cho 13 gam kẽm vào dung dịch HCl dư được khí thoát ra tính thể khí thu được (dktc)

Những câu hỏi liên quan
Hòa tan vừa đủ 13 gam kẽm vào dung dịch chứa a gam axit HCL 15%
a) Viết phương trình phản ứng
b) Tính thể tích khí hidro thu được ở dktc
\(n_{Zn}=\dfrac{13}{65}=0,2mol\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,2 0,2 ( mol )
\(V_{H_2}=0,2.22,4=4,48l\)
Đúng 2
Bình luận (0)
Zn+2HCl->ZnCl2+H2
0,2--------------------------0,2
nZn=0,2 mol
->VH2=0,2.22,4=4,48l
Đúng 1
Bình luận (0)
`a)PTPƯ: Zn + 2HCl -> ZnCl_2 + H_2↑`
`b) n_[Zn] = 13 / 65 = 0,2 (mol)`
Theo `PTPƯ` có: `n_[H_2] = n_[Zn] = 0,2 (mol)`
`-> V_[H_2] = 0,2 . 22,4 = 4.48 (l)`
Đúng 0
Bình luận (0)
Xem thêm câu trả lời
Cho 6,5 kẽm tác dụng hoàn toàn với 200ml dung dịch HCl thu được dung dịch muối kẽm clorua và khí hidro ( dktc)
a) TÍnh thể tích khí H2 sinh ra ( ở dktc)
b) tính nồng độ mol của dung dịch HCl đã dùng
c) Dẫn toàn bộ lượng khí hidro thu được đi qua 20g bột CuO nung nóng. Tính khối lượng đồng thu được sau phản ứng
\(n_{Zn}=\dfrac{6,5}{65}=0,1\left(mol\right)\)
\(n_{CuO}=\dfrac{20}{80}=0,25\left(mol\right)\)
PTHH: Zn + 2HCl ---> ZnCl2 + H2
0,1---->0,1----------------->0,1
=> \(\left\{{}\begin{matrix}V_{H_2}=0,1.22,4=2,24\left(l\right)\\C_{M\left(HCl\right)}=\dfrac{0,2}{0,2}=1M\end{matrix}\right.\)
PTHH: CuO + H2 --to--> Cu + H2O
LTL: 0,25 > 0,1 => CuO dư
Theo pthh: nCu = nH2 = 0,1 (mol)
=> mCu = 0,1.64 = 6,4 (g)
Đúng 3
Bình luận (0)
\(n_{Zn}=\dfrac{6,5}{65}=0,1\left(mol\right)\\
pthh:Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,1 0,2 0,2
\(V_{H_2}=0,2.22,4=4,48l\\
C_M=\dfrac{0,2}{0,2}=1M\\
n_{CuO}=\dfrac{20}{80}=0,25\left(G\right)\\
pthh:CuO+H_2\underrightarrow{t^o}Cu+H_2O\\
LTL:0,25>0,1\)
=>CuO dư
\(n_{Cu}=n_{H_2}=0,1\left(mol\right)\\
m_{Cu}=0,1.64=6,4g\)
Đúng 0
Bình luận (0)
câu 1:Nhiệt phân hoàn toàn 49 gam KClO3.Hãy tính:a)Khối lượng KCl thu đượcb)Thể tích khí O2 thoát ra(đktc)câu 2:Cho 6,5 gam kẽm tác dụng vừa đủ với dung dịch HCl thu được ZnCl2 và khí H2a)Tính thể tích khí H2 thoát ra(đktc)b)Tính khối lượng HCl cần dùngc)Dùng toàn bộ lượng khí H2 trên khử CuO ở nhiệt độ cao.Tính khối lượng Cu thu được.câu 3:Đốt cháy 6,4 gam lưu huỳnh trong bình chứa 2,24 lít khí O2(đktc).tính:a)thể tích khí SO2 thu được(đktc)b)khối lượng chất dư sau phản ứng.Mình đang cần gấp ma...
Đọc tiếp
câu 1:Nhiệt phân hoàn toàn 49 gam KClO3.Hãy tính:
a)Khối lượng KCl thu được
b)Thể tích khí O2 thoát ra(đktc)
câu 2:Cho 6,5 gam kẽm tác dụng vừa đủ với dung dịch HCl thu được ZnCl2 và khí H2
a)Tính thể tích khí H2 thoát ra(đktc)
b)Tính khối lượng HCl cần dùng
c)Dùng toàn bộ lượng khí H2 trên khử CuO ở nhiệt độ cao.Tính khối lượng Cu thu được.
câu 3:Đốt cháy 6,4 gam lưu huỳnh trong bình chứa 2,24 lít khí O2(đktc).tính:
a)thể tích khí SO2 thu được(đktc)
b)khối lượng chất dư sau phản ứng.
Mình đang cần gấp mai là nộp gòi các bạn giúp mình với làm ơn
nKClO3 = 49 : 122,5 =0,4(mol)
a) pthh : 2KClO3 -t--> 2KCl + 3O2
0,4------------>0,4----->0,6(mol)
mKCl = 0,4.74,5=29,8 (g)
VO2= 0,6.22,4= 13,44 (l)
câu 2
a nZn = 6,5:65=0,1(mol)
pthh : Zn +2HCl ---> ZnCl2 + H2
0,1->0,2----------------->0,1(mol)
=> VH2 = 0,1.22,4 =2,24(l)
=> mHCl = 0,2 . 36,5=7,3 (g)
Đúng 3
Bình luận (1)
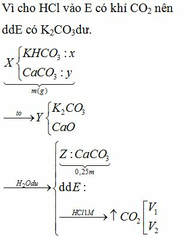
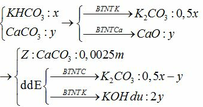
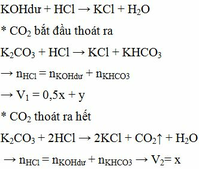
Nung m gam hỗn hợp X gồm KHCO3 và CaCO3 ở nhiệt độ cao đến khi khối lượng không đổi thu được chất rắn Y. Cho Y vào nước dư, thu được 0,25m gam chất rắn Z và dung dịch E. Nếu nhỏ từ từ dung dịch HCl vào E, khi khí bắt đầu thoát ra cần dùng V1 lít dung dịch HCl 1M. Còn nếu nhỏ từ từ dung dịch HCl vào E, khí thoát ra hết thì thể tích dung dịch HCl 1M đã dùng là V2 lít. Tính thể tích V1:V2.
Đọc tiếp
Nung m gam hỗn hợp X gồm KHCO3 và CaCO3 ở nhiệt độ cao đến khi khối lượng không đổi thu được chất rắn Y. Cho Y vào nước dư, thu được 0,25m gam chất rắn Z và dung dịch E. Nếu nhỏ từ từ dung dịch HCl vào E, khi khí bắt đầu thoát ra cần dùng V1 lít dung dịch HCl 1M. Còn nếu nhỏ từ từ dung dịch HCl vào E, khí thoát ra hết thì thể tích dung dịch HCl 1M đã dùng là V2 lít. Tính thể tích V1:V2.
Cho 6,5 gam zinc ( kẽm Zn) vào dung dịch HCl dư. Tính khối lượng muối có trong dung dịch và thể tích khí hydrogen thu được.
Zn+2HCl->ZnCl2+H2
0,1--------------0,1-0,1
n Zn=0,1 mol
=>m Zncl2=0,1.136=13,6g
=>VH2=0,1.22,4=2,24l
Đúng 3
Bình luận (0)
cho 13 gam kẽm hòa tan hoàn toàn vào dung dịch chứa 0.15mol hcl
a)tính V khí sinh ra ở dktc
b)tính khối lượng chất tạo thành
c)kẽm hay HCl dư , dư bao nhiêu gam hoặc mol
Nung m gam hỗn hợp X gồm KHCO3 và CaCO3 ở nhiệt độ cao đến khối lượng không đổi, thu được chất rắn Y. Cho Y vào nước dư, thu được 0,25m gam chất rắn Z và dung dịch E. Nhỏ từ từ dung dịch HCl 1M vào E, khi khí bắt đầu thoát ra cần dụng V1 lít dung dịch HCl và khi khí thoát ra hết, thì thể tích dung dịch HCl đã dùng là V2 lít. Tỉ lệ V1: A. 2:3. B. 3:5. C. 3:4. D. 5:6.
Đọc tiếp
Nung m gam hỗn hợp X gồm KHCO3 và CaCO3 ở nhiệt độ cao đến khối lượng không đổi, thu được chất rắn Y. Cho Y vào nước dư, thu được 0,25m gam chất rắn Z và dung dịch E. Nhỏ từ từ dung dịch HCl 1M vào E, khi khí bắt đầu thoát ra cần dụng V1 lít dung dịch HCl và khi khí thoát ra hết, thì thể tích dung dịch HCl đã dùng là V2 lít. Tỉ lệ V1:
A. 2:3.
B. 3:5.
C. 3:4.
D. 5:6.
Cho 13 gam kẽm phản ứng hoàn toàn với dung dịch axit clohiđric (HCl) dư, thu được muối kẽm clorua (ZnCl2) và khí hiđroa, Viết phương trình hóa học cho phản ứng trên.b, Xác định khối lượng muối kẽm clorua tạo thành.c, Tính thể tích hiđro sinh ra ( đktc ).d, Lượng khí Hidro thu được ở trên qua bình đựng 32 g CuO nung nóng thu được m gam chất rắn. Tính % khối lượng các chất có trong m gam chất rắn ?
Đọc tiếp
Cho 13 gam kẽm phản ứng hoàn toàn với dung dịch axit clohiđric (HCl) dư, thu được muối kẽm clorua (ZnCl2) và khí hiđro
a, Viết phương trình hóa học cho phản ứng trên.
b, Xác định khối lượng muối kẽm clorua tạo thành.
c, Tính thể tích hiđro sinh ra ( đktc ).
d, Lượng khí Hidro thu được ở trên qua bình đựng 32 g CuO nung nóng thu được m gam chất rắn. Tính % khối lượng các chất có trong m gam chất rắn ?
a.b.c.\(n_{Zn}=\dfrac{m}{M}=\dfrac{13}{65}=0,2mol\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,2 0,2 0,2 ( mol )
\(m_{ZnCl_2}=n.M=0,2.136=27,2g\)
\(V_{H_2}=n.22,4=0,2.22,4=4,48l\)
d.\(n_{CuO}=\dfrac{m}{M}=\dfrac{32}{80}=0,4mol\)
\(CuO+H_2\rightarrow\left(t^o\right)Cu+H_2O\)
0,4 > 0,2 ( mol )
0,2 0,2 0,2 ( mol )
\(m_{chất.rắn}=m_{CuO\left(dư\right)}+m_{Cu}=0,2.80+0,2.64=16+12,8=28,8g\)
\(\%m_{CuO}=\dfrac{16}{28,8}.100=55,55\%\)
\(\%m_{Cu}=100\%-55,55\%=44,45\%\)
Đúng 3
Bình luận (0)
Cho 13 gam kẽm vào bình chứa dung dịch axit clohidric (HCl) thu được kẽm clorua (ZnCl2) và khí hidro
a) Lập phương trình hóa học
b) Nếu lượng HCl là 21,9 gam thì Zn, HCl chất nào còn dư? Dư bao nhiêu mol?
c) Tính khối lượng ZnCl2 tạo thành, thể tích khí hidro bay ra (ở đktc)
\(a,Zn+2HCl\to ZnCl_2+H_2\\ b,n_{Zn}=\dfrac{13}{65}=0,2(mol);n_{HCl}=\dfrac{21,9}{36,5}=0,6(mol)\)
Vì \(\dfrac{n_{Zn}}{1}<\dfrac{n_{HCl}}{2}\) nên \(HCl\) dư
\(n_{HCl(dư)}=0,6-0,2.2=0,2(mol)\\ c,n_{ZnCl_2}=n_{H_2}=n_{Zn}=0,2(mol)\\ \Rightarrow m_{ZnCl_2}=0,2.136=27,2(g)\\ V_{H_2}=0,2.22,4=4,48(l)\)
Đúng 1
Bình luận (0)