Nếu như với dung dịch mầm của mầm lúa cho thêm ít (tầm 100 ml )thì có tạo ra sản phầm không

Những câu hỏi liên quan
Có một hỗn hợp khí X gồm etilen và axetilen. Nếu cho V lít khí X phản ứng với dung dịch AgNO3/NH3 dư thì tạo ra 9,6 gam kết tủa. Mặt khác nếu cho V lít khí X như trên phản ứng hết với dung dịch brom thì khối lượng bình đựng dung dịch brom tăng 2,72 gam. Đốt cháy hết V lít hỗn hợp khí X và dẫn sản phẩm cháy vào cốc chứa 100 ml dung dịch NaOH 1,5M thì muối tạo thành trong dung dịch và số mol thu được là: A. Hỗn hợp Na2CO3; 0,075 mol và NaHCO3 0,15 mol. B. Na2CO3 và 0,075 mol. C. Na2CO3 và 0,2 m...
Đọc tiếp
Có một hỗn hợp khí X gồm etilen và axetilen. Nếu cho V lít khí X phản ứng với dung dịch AgNO3/NH3 dư thì tạo ra 9,6 gam kết tủa. Mặt khác nếu cho V lít khí X như trên phản ứng hết với dung dịch brom thì khối lượng bình đựng dung dịch brom tăng 2,72 gam. Đốt cháy hết V lít hỗn hợp khí X và dẫn sản phẩm cháy vào cốc chứa 100 ml dung dịch NaOH 1,5M thì muối tạo thành trong dung dịch và số mol thu được là:
A. Hỗn hợp Na2CO3; 0,075 mol và NaHCO3 0,15 mol.
B. Na2CO3 và 0,075 mol.
C. Na2CO3 và 0,2 mol.
D. NaHCO3 và 0,15 mol.
Chọn D
C2H2 + AgNO3 -> Ag2C2↓
=> nkết tủa = nC2H2 =0,04 mol
,mbình tăng = mC2H2 + mC2H4 = 2,72g => nC2H4 = 0,06 mol
Đốt cháy : nCO2 = 2nC2H2 + 2nC2H4 = 0,2 mol
nOH = 0,15 mol < nCO2
=> phản ứng chỉ tạo HCO3 với số mol là 0,15 mol
Đúng 0
Bình luận (0)
Ở một loài thực vật sinh sản bằng tự phối, gen A quy định hạt nảy mầm bình thường trội hoàn toàn so với alen a làm cho hạt không nảy mầm. Tiến hành gieo 100 hat (40AA:60Aa) lên đất canh tác, các hạt sau khi nảy mầm đều sinh trưởng và phát triển bình thường và các cây đều ra hoa, kết hạt tạo nên thế hệ F1, F1 nảy mầm và sinh trưởng, sau đó ra hoa và kết hạt tạo thế hệ F2. Ở các hạt F2, kiểu gen Aa có tỷ lệ là A. 11/17 B. 6/17 C. 3/17 D. 25/17
Đọc tiếp
Ở một loài thực vật sinh sản bằng tự phối, gen A quy định hạt nảy mầm bình thường trội hoàn toàn so với alen a làm cho hạt không nảy mầm. Tiến hành gieo 100 hat (40AA:60Aa) lên đất canh tác, các hạt sau khi nảy mầm đều sinh trưởng và phát triển bình thường và các cây đều ra hoa, kết hạt tạo nên thế hệ F1, F1 nảy mầm và sinh trưởng, sau đó ra hoa và kết hạt tạo thế hệ F2. Ở các hạt F2, kiểu gen Aa có tỷ lệ là
A. 11/17
B. 6/17
C. 3/17
D. 25/17
ở một loài thực vật sinh sản bằng tự phối, gen A quy định hạt nảy mầm bình thường trội hoàn toàn so với alen a làm cho hạt không nảy mầm. Tiến hành gieo 100 hạt (gồm 40 hạt AA, 60 hạt Aa) lên đất canh tác, các hạt sau khi nảy mầm đều sinh trưởng bình thường và các cây đều ra hoa, kết hạt tạo nên thế hệ F1; F1 nảy mầm và sinh trưởng, sau đó ra hoa kết hạt tạo thế hệ F2. Ở các hạt F2, kiểu gen Aa có tỉ lệ là A. 11/17 B. 6/17 C. 3/17 D. 25/34
Đọc tiếp
ở một loài thực vật sinh sản bằng tự phối, gen A quy định hạt nảy mầm bình thường trội hoàn toàn so với alen a làm cho hạt không nảy mầm. Tiến hành gieo 100 hạt (gồm 40 hạt AA, 60 hạt Aa) lên đất canh tác, các hạt sau khi nảy mầm đều sinh trưởng bình thường và các cây đều ra hoa, kết hạt tạo nên thế hệ F1; F1 nảy mầm và sinh trưởng, sau đó ra hoa kết hạt tạo thế hệ F2. Ở các hạt F2, kiểu gen Aa có tỉ lệ là
A. 11/17
B. 6/17
C. 3/17
D. 25/34
Ở một loài thực vật sinh sản bằng tự phối, gen A quy định hạt nảy mầm bình thường trội hoàn toàn so với alen a làm cho hạt không nảy mầm. Tiến hành gieo 100 hạt (gồm 40 hạt AA, 60 hạt Aa) lên đất canh tác, các hạt sau khi nảy mầm đều sinh trưởng bình thường và các cây đều ra hoa, kết hạt tạo nên thế hệ F1; F1 nảy mầm và sinh trưởng, sau đó ra hoa kết hạt tạo thế hệ F2. Ở các hạt F2, kiểu gen Aa có tỉ lệ là A. 11/17 B. 6/17 C. 3/17 D. 25/34
Đọc tiếp
Ở một loài thực vật sinh sản bằng tự phối, gen A quy định hạt nảy mầm bình thường trội hoàn toàn so với alen a làm cho hạt không nảy mầm. Tiến hành gieo 100 hạt (gồm 40 hạt AA, 60 hạt Aa) lên đất canh tác, các hạt sau khi nảy mầm đều sinh trưởng bình thường và các cây đều ra hoa, kết hạt tạo nên thế hệ F1; F1 nảy mầm và sinh trưởng, sau đó ra hoa kết hạt tạo thế hệ F2. Ở các hạt F2, kiểu gen Aa có tỉ lệ là
A. 11/17
B. 6/17
C. 3/17
D. 25/34
Chọn đáp án C
Ta có 0,4 AA và 0,6Aa tự thụ phấn
F1: 0,4AA + 0,15AA + 0,3Aa + 0,15aa = 0,55AA + 0,3Aa + 0,15aa tự thụ phấn
Và aa không nảy mầm
F2: Aa = 0,3/0,85 × 1/2 = 3/17
Đúng 0
Bình luận (0)
Ở một loài thực vật sinh sản bằng tự phối, gen A quy định hạt nảy mầm bình thường trội hoàn toàn so với alen a làm cho hạt không nảy mầm. Tiến hành gieo 100 hat (40AA:60Aa) lên đất canh tác, các hạt sau khi nảy mầm đều sinh trưởng và phát triển bình thường và các cây đều ra hoa, kết hạt tạo nên thế hệ F1, F1 nảy mầm và sinh trưởng, sau đó ra hoa và kết hạt tạo thế hệ F2. Ở các hạt F2, kiểu gen Aa có tỷ lệ là A. 11/17 B. 6/17 C. 3/17 D. 25/17
Đọc tiếp
Ở một loài thực vật sinh sản bằng tự phối, gen A quy định hạt nảy mầm bình thường trội hoàn toàn so với alen a làm cho hạt không nảy mầm. Tiến hành gieo 100 hat (40AA:60Aa) lên đất canh tác, các hạt sau khi nảy mầm đều sinh trưởng và phát triển bình thường và các cây đều ra hoa, kết hạt tạo nên thế hệ F1, F1 nảy mầm và sinh trưởng, sau đó ra hoa và kết hạt tạo thế hệ F2. Ở các hạt F2, kiểu gen Aa có tỷ lệ là
A. 11/17
B. 6/17
C. 3/17
D. 25/17
Cho 0,01 mol một este X phản ứng hết với 100 ml dung dịch NaOH 0,2M, sản phẩm tạo ra chỉ gồm một muối và một ancol đều có số mol bằng số mol este, đều có cấu tạo mạch cacbon không phân nhánh. Mặt khác xà phòng hóa hoàn toàn một lượng este X bằng dung dịch KOH vừa đủ, thì vừa hết 200 ml KOH 0,15M và thu được 3,33 gam muối. X là: A. Etylenglycol Oxalat B. Đimetyl ađipat C. Đietyl oxalat D. Etylenglicol ađipat
Đọc tiếp
Cho 0,01 mol một este X phản ứng hết với 100 ml dung dịch NaOH 0,2M, sản phẩm tạo ra chỉ gồm một muối và một ancol đều có số mol bằng số mol este, đều có cấu tạo mạch cacbon không phân nhánh. Mặt khác xà phòng hóa hoàn toàn một lượng este X bằng dung dịch KOH vừa đủ, thì vừa hết 200 ml KOH 0,15M và thu được 3,33 gam muối. X là:
A. Etylenglycol Oxalat
B. Đimetyl ađipat
C. Đietyl oxalat
D. Etylenglicol ađipat
Đáp án D
Este X phản ứng với NaOH theo tỉ lệ 1 : 2 nhưng lại cho sản phẩm chỉ chứa 1 muối và 1 ancol có số mol bằng số mol este
X là este được tạo bởi 1 axit 2 chức và 1 ancol 2 chức. Ngoài ra chúng ta có thể quan sát đáp án và rút ra kết luận trên.

Đúng 0
Bình luận (0)
Một quần thể giao phấn hoàn toàn ngẫu nhiên. Alen A quy định khả năng nảy mầm trên đất có kim loại nặng, alen a không có khả năng này nên hạt mang kiểu gen aa bị chết trên đất có kim loại nặng. Tiến hành gieo 100 hạt trong đó có 20 hạt có kiểu gen AA, 40 hạt có kiểu gen Aa, 40 hạt có kiểu gen aa trên đất có kim loại nặng. Các hạt sau khi nảy mầm đều sinh trưởng bình thường và các cây đều ra hoa, kết hạt với tỉ lệ như nhau cho thế hệ F1. Các cây F1 ngẫu phối tạo F2. Nếu không có đột biến xảy ra,...
Đọc tiếp
Một quần thể giao phấn hoàn toàn ngẫu nhiên. Alen A quy định khả năng nảy mầm trên đất có kim loại nặng, alen a không có khả năng này nên hạt mang kiểu gen aa bị chết trên đất có kim loại nặng. Tiến hành gieo 100 hạt trong đó có 20 hạt có kiểu gen AA, 40 hạt có kiểu gen Aa, 40 hạt có kiểu gen aa trên đất có kim loại nặng. Các hạt sau khi nảy mầm đều sinh trưởng bình thường và các cây đều ra hoa, kết hạt với tỉ lệ như nhau cho thế hệ F1. Các cây F1 ngẫu phối tạo F2. Nếu không có đột biến xảy ra, theo lí thuyết, tỉ lệ F2 nảy mầm trên có kim loại nặng bao nhiêu?
A. 1/16
B. 48/49
C. 1/9
D. 15/16
Đáp án A
Ta có : P: 20 hạt AA : 40 hạt Aa (tham gia sinh sản)
→ P: 1/3 AA : 2/3 Aa
→ Tần số alen a = 2/3 : 2 = 1/3, A = 2/3
Vậy F1 : 4/9 AA : 4/9 Aa : 1/9 aa
→ Tỉ lệ các cây F1 tham gia ra hoa, kết quả : 1/2 AA : 1/2 Aa
→ a = 1/2 : 2 = 1/4
Vậy tỉ lệ hạt không nảy mầm được (aa) = (1/4)^2 = 1/16
Đúng 0
Bình luận (0)
Chất sau có tác dụng với dung dịch NaOH không? Nếu có thì tạo ra sản phẩm hữu cơ nàoA. không có tác dụngB. có tác dụng, tạo ra C. có tác dụng, tạo ra D. có tác dụng, tạo ra
Đọc tiếp
Chất sau có tác dụng với dung dịch NaOH không? Nếu có thì tạo ra sản phẩm hữu cơ nào
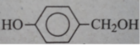
A. không có tác dụng
B. có tác dụng, tạo ra 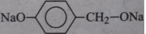
C. có tác dụng, tạo ra 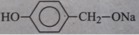
D. có tác dụng, tạo ra 
Câu 2: Cho 200 ml dung dịch KOH 1M tác dụng với 200 ml dung dịch H2SO4 1M, sau phản ứng cho thêm một mảnh Mg dư vào sản phẩm thấy thoát ra một thể tích khí H2 (đktc) là bao nhiêu?Câu 7: Trung hoà 100 ml dung dịch H2SO4 1M bằng V ml dung dịch NaOH 1M. Tính giá trị của V.Câu 8: Để trung hòa hết 700 ml dung dịch H2SO4 0,5M cần V ml thể tích dung dịch KOH 12% (D 1,15 g/ml). Tính giá trị của V.Câu 10: Trộn 400 gam dung dịch KOH 5,6% với 300 gam dung dịch CuSO4 16%. Tính khối lượng kết tủa tạo thành....
Đọc tiếp
Câu 2: Cho 200 ml dung dịch KOH 1M tác dụng với 200 ml dung dịch H2SO4 1M, sau phản ứng cho thêm một mảnh Mg dư vào sản phẩm thấy thoát ra một thể tích khí H2 (đktc) là bao nhiêu?
Câu 7: Trung hoà 100 ml dung dịch H2SO4 1M bằng V ml dung dịch NaOH 1M. Tính giá trị của V.
Câu 8: Để trung hòa hết 700 ml dung dịch H2SO4 0,5M cần V ml thể tích dung dịch KOH 12% (D = 1,15 g/ml). Tính giá trị của V.
Câu 10: Trộn 400 gam dung dịch KOH 5,6% với 300 gam dung dịch CuSO4 16%. Tính khối lượng kết tủa tạo thành.
Câu 11: Cho 100 ml dung dịch BaCl2 1M tác dụng vừa đủ 100 ml dung dịch K2CO3. Tính nồng độ mol của chất tan trong dung dịch thu được sau phản ứng.
Câu 12. Viết PTHH hoàn thành dãy chuyển hóa sau
a) Cu -> CuO -> CuCl2 -> Cu(OH)2 -> CuO -> CuSO4 -> Cu.
b) MgSO4 -> Mg(OH)2 -> MgO -> MgCl2 -> Mg(NO3)2 ->MgCO3 -> MgO.
c) Na -> NaOH -> NaCl -> Cl2 -> HCl -> FeCl2 -> Fe(OH)2 -> FeO
d) Fe -> FeCl3 -> Fe(OH)3 -> Fe2O3 -> Fe -> FeCl2 -> Fe(OH)2 -> FeSO4
-> FeCl2 -> Fe(NO3)2 -> Fe.
e) Al -> Al2O3 -> AlCl3 -> Al2(SO4)3 -> Al(OH)3 -> Al(NO3)3 -> Al -> AlCl3
Câu 7 :
\(n_{H2SO4}=0,1.1=0,1\left(mol\right)\)
Pt : \(H_2SO_4+2NaOH\rightarrow Na_2SO_4+2H_2O\)
\(n_{NaOH}=2n_{H2SO4}=2.0,1=0,2\left(mol\right)\Rightarrow V_{ddNaOH}=\dfrac{0,2}{1}=0,2\left(l\right)=200\left(ml\right)\)
Câu 8 :
\(n_{H2SO4}=0,5.0,7=0,35\left(mol\right)\)
Pt : \(H_2SO_4+2KOH\rightarrow K_2SO_4+H_2O\)
\(n_{KOH}=2n_{H2SO4}=2.0,35=0,7\left(mol\right)\)
\(\Rightarrow m_{ddKOH}=\dfrac{0,7.56}{12\%}.100\%=326,67\left(g\right)\)
\(\Rightarrow V_{ddKOH}=\dfrac{326,67}{1,15}=284,06\left(ml\right)\)
Đúng 4
Bình luận (0)
Câu 12 :
a) \(2Cu+O_2\xrightarrow[]{t^o}2CuO\)
\(CuO+2HCl\rightarrow CuCl_2+H_2O\)
\(CuCl_2+2NaOH\rightarrow Cu\left(OH\right)_2+2NaCl\)
\(Cu\left(OH\right)_2\xrightarrow[]{t^o}CuO+H_2O\)
\(CuO+H_2SO_4\rightarrow CuSO_4+H_2O\)
\(CuSO_4+Fe\rightarrow FeSO_4+Cu\downarrow\)
b) \(MgSO_4+2KOH\rightarrow Mg\left(OH\right)_2+K_2SO_4\)
\(Mg\left(OH\right)_2\xrightarrow[]{t^o}MgO+H_2O\)
\(MgO+2HCl\rightarrow MgCl_2+H_2O\)
\(MgCl_2+2AgNO_3\rightarrow Mg\left(NO_3\right)_2+2AgCl\)
\(Mg\left(NO_3\right)_2+Na_2CO_3\rightarrow MgCO_3+2NaNO_3\)
\(MgCO_3\xrightarrow[]{t^o}MgO+CO_2\)
c) \(2Na+2H_2O\rightarrow2NaOH+H_2\)
\(NaOH=HCl\rightarrow NaCl+H_2O\)
\(2NaCl+2H_2O\xrightarrow[cmn]{đpdd}2NaOH+H_2+Cl_2\)
\(Cl_2+H_2\xrightarrow[]{as}2HCl\)
\(HCl+Fe\rightarrow FeCl_2+H_2\)
\(FeCl_2+2NaOH\rightarrow Fe\left(OH\right)_2+2NaCl\)
\(Fe\left(OH\right)_2+H_2SO_4\rightarrow FeSO_4+2H_2O\)
\(FeSO_4+BaCl_2\rightarrow FeCl_2+BaSO_4\)
\(FeCl_2+2AgNO_3\rightarrow Fe\left(NO_3\right)_2+2AgCl\)
\(Fe\left(NO_3\right)_2+Mg\rightarrow Mg\left(NO_3\right)_2+Fe\)
e) \(4Al+3O_2\xrightarrow[]{t^o}2Al_2O_3\)
\(Al_2O_3+6HCl\rightarrow2AlCl_3+3H_2O\)
\(Al_2\left(SO_4\right)_3+6KOH\rightarrow2Al\left(OH\right)_3+3K_2SO_4\)
\(Al\left(OH\right)_3+3HNO_3\rightarrow Al\left(NO_3\right)_3+3H_2O\)
\(Al\left(NO_3\right)_2+Mg\rightarrow Mg\left(NO_3\right)_2+Âl\)
\(2Al+3Cl_2\xrightarrow[]{t^o}2AlCl_3\)
Bạn xem đề chỗ AlCl3 ra Al2(SO4)3 nhé
Đúng 2
Bình luận (1)
Câu 10 :
\(n_{KOH}=\dfrac{5,6\%.400}{100\%.56}=0,4\left(mol\right)\)
\(n_{CuSO4}=\dfrac{16\%.300}{100\%.160}=0,3\left(mol\right)\)
Pt : \(2KOH+CuSO_4\rightarrow K_2SO_4+Cu\left(OH\right)_2\)
0,4 0,3 0,2
Xét tỉ lệ : \(\dfrac{0,4}{2}< \dfrac{0,3}{1}\Rightarrow CuSO_4dư\)
\(\Rightarrow m_{kt}=m_{Cu\left(OH\right)2}=0,2.98=19,6\left(g\right)\)
Câu 11 :
\(n_{BaCl2}=0,1.1=0,1\left(mol\right)\)
Pt : \(BaCl_2+K_2CO_3\rightarrow BaCO_3+2KCl\)
\(n_{KCl}=2n_{BaCl2}=2.0,1=0,2\left(mol\right)\Rightarrow C_{MKCl}=\dfrac{0,2}{0,1+0,1}=1M\)
Đúng 2
Bình luận (0)











