
Những câu hỏi liên quan
Công thức hoá học đơn giản nhất của một loại oxit của sắt, biết rằng trong oxit này có 7 gam sắt kết hợp với 2 gam oxi.
A. FeO B. Fe2O3 C. Fe3O4 D. Không có.
Trong một oxit của nitơ, cứ 7 g N kết hợp với 16 g O. Công thức hoá học đơn giản oxit của nitơ là Mọi người giúp mình với ạ, mình cảm ơn❤
\(CT:N_xO_y\)
\(x:y=\dfrac{7}{14}:\dfrac{16}{16}=0.5:1=1:2\)
CT đơn giản nhất : \(NO_2\)
Chúc em học tốt !
Đúng 4
Bình luận (0)
Biết tỉ lệ khối lượng của N và O trong một hợp chất oxit của nitơ là 7 : 12. Tìm công thức hóa học của oxit đó và xác định hóa trị của N trong oxit.
Gọi CTHH là \(N_xO_y\)
Ta có:
\(x:y=\dfrac{m_N}{14}:\dfrac{m_O}{16}=\dfrac{7}{14}:\dfrac{12}{16}=0,5:0,75=1:1,5=2:3\)
Vậy CTHH là \(N_2O_3\)
Gọi \(x\) là hóa trị của N.
\(\Rightarrow2x=3\cdot2\Rightarrow x=3\)
Vậy N có hóa trị lll.
Đúng 1
Bình luận (0)
hãy tìm cthh đơn giản nhất của một loại lưu huỳnh oxit, biết rằng trong oxit này có 2 gam s kết hợp với 3 gam oxi
mai mình nộp rồi
Gọi CTHH của oxit là SxOy
Ta có: x: y = \(\dfrac{2}{32}:\dfrac{3}{16}=1:3\)
=> x = 1; y = 3
Vậy CTHH: SO3
Đúng 0
Bình luận (0)
Gọi CTHH của oxit là SxOy
Ta có: x: y = 232:316=1:3232:316=1:3
=> x = 1; y = 3
Vậy CTHH: SO3
Đúng 0
Bình luận (0)
Hãy tìm công thức hóa học đơn giản nhất của một loại oxit của lưu huỳnh, biết rằng trong oxit này có 2g lưu huỳnh kết hợp với 3g oxi.
Số mol của nguyên tử lưu huỳnh là: 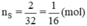
Số mol của nguyên tử oxi là: 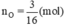
Ta có: 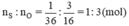
⇒ Trong một phân tử lưu huỳnh trioxit có 1 nguyên tử S và có 3 nguyên tử O.
Vậy công thức hóa học đơn giản nhất của oxit lưu huỳnh là SO3.
Đúng 0
Bình luận (0)
Hãy tìm công thức hóa học đơn giản nhất của một loại oxit của lưu huỳnh, biết rằng trong oxit này có 2 g lưu huỳnh kết hợp với 3 g oxi.
\(\frac{n_S}{n_O}=\frac{\frac{2}{32}}{\frac{3}{16}}=\frac{1}{3}\Rightarrow SO_3\)
Đúng 0
Bình luận (1)
Giả sử CTHH là SxOy , ta có tỉ lệ:
\(\dfrac{x}{y}\)=\(\dfrac{2}{32}\):\(\dfrac{3}{16}\)=\(\dfrac{1}{3}\)⇒CTHH là SO3
Đúng 0
Bình luận (1)
Giả sử CTHH là SxOy , ta có tỉ lệ:
xyxy=232232:316316=1313⇒CTHH là SO3
Đúng 0
Bình luận (0)
Xem thêm câu trả lời
Đốt cháy hoàn toàn 2,4 gam Mg trong khí oxi thu được 4 gam Magie oxit . Tìm công thức đơn giản của magie oxit.
( Biết O=16:C=12:Mg=24:H=1:S=32:N=14:K=39)
Bài 5. a) Hãy xác định công thức của một loại oxit sắt, biết rằng khi cho 32 gam oxit sắt này tác dụng hoàn toàn với khí cacbon oxit thì thu được 22,4 gam chất rắn. Biết khối lượng mol phân tử của oxit sắt là 160 gam/mol. b) Chất khí sinh ra được hấp thụ hoàn toàn bằng nước vôi trong dư. Tính khối lượng kết tủa thu được.
a) Gọi CTHH của oxit sắt là $Fe_2O_n$
$Fe_2O_n + nCO \xrightarrow{t^o} 2Fe +nCO_2$
$n_{Fe} = \dfrac{22,4}{56} = 0,2(mol)$
$\Rightarrow n_{Fe_2O_n} = \dfrac{1}{2}n_{Fe} = 0,2(mol)$
$M_{oxit} = 56.2 + 16n = \dfrac{32}{0,2}=160$
Suy ra : n = 3
Vậy oxit cần tìm là $Fe_2O_3$
b) $n_{CO_2} = \dfrac{3}{2}n_{Fe} = 0,6(mol)$
$CO_2 +C a(OH)_2 \to CaCO_3 + H_2O$
$n_{CaCO_3} = n_{CO_2} = 0,6(mol)$
$m_{CaCO_3} = 0,6.100 = 60(gam)$
Đúng 1
Bình luận (0)
Khử hoàn toàn 28 gam hỗn hợp gồm CuO và một oxit của sắt bằng khí H2 dư ở nhiệt độ cao. Sau phản ứng thu được hỗn hợp ở chất rắn, cho hỗn hợp rắn này tác dụng hoàn toàn với axit H2SO4 loãng thấy thoát ra 3,36 lít khí H2 (ở đkct) và 12,8 gam chất rắn.a. tìm công thức oxit của sắtb. tìm thành phần phần trăm theo khối lượng của mỗi oxit trong hỗn hợp ban đầu.c. hòa tan 28 gam hỗn hợp trên và dung dịch HCl 8%. Tính khối lượng dung dịch HCl cần dùng, biết rằng người ta đã dùng axit dư 15% so với lý t...
Đọc tiếp
Khử hoàn toàn 28 gam hỗn hợp gồm CuO và một oxit của sắt bằng khí H2 dư ở nhiệt độ cao. Sau phản ứng thu được hỗn hợp ở chất rắn, cho hỗn hợp rắn này tác dụng hoàn toàn với axit H2SO4 loãng thấy thoát ra 3,36 lít khí H2 (ở đkct) và 12,8 gam chất rắn.
a. tìm công thức oxit của sắt
b. tìm thành phần phần trăm theo khối lượng của mỗi oxit trong hỗn hợp ban đầu.
c. hòa tan 28 gam hỗn hợp trên và dung dịch HCl 8%. Tính khối lượng dung dịch HCl cần dùng, biết rằng người ta đã dùng axit dư 15% so với lý thuyết.
























