Hòa tan hết 6g hợp kim Cu – Ag trong dung dịch HNO3 tạo ra được 14,68g hỗn hợp muối Cu(NO3)2 và AgNO3. Thành phần % khối lượng của hợp kim là
A. 50% Cu và 50% Ag.
B. 64% Cu và 36 % Ag.
C. 36% Cu và 64% Ag
D. 60% Cu và 40% Ag.
Hòa tan hết 6g hợp kim Cu – Ag trong dung dịch HNO3 tạo ra được 14,68g hỗn hợp muối Cu(NO3)2 và AgNO3. Thành phần % khối lượng của hợp kim là
A. 50% Cu và 50% Ag.
B. 64% Cu và 36 % Ag.
C. 36% Cu và 64% Ag
D. 60% Cu và 40% Ag.
Hòa tan hết 6g hợp kim Cu – Ag trong dung dịch HNO3 tạo ra được 14,68g hỗn hợp muối Cu(NO3)2 và AgNO3. Thành phần % khối lượng của hợp kim là
A. 50% Cu và 50% Ag..
B. 64% Cu và 36 % Ag.
C. 36% Cu và 64% Ag
D. 60% Cu và 40% Ag
Hòa tan hết 6g hợp kim Cu – Ag trong dung dịch HNO3 tạo ra được 14,68g hỗn hợp muối Cu(NO3)2 và AgNO3. Thành phần % khối lượng của hợp kim là
A. 50% Cu và 50% Ag.
B. 64% Cu và 36 % Ag.
C. 36% Cu và 64% Ag
D. 60% Cu và 40% Ag
Hòa tan hết 6g hợp kim Cu – Ag trong dung dịch HNO3 tạo ra được 14,68g hỗn hợp muối Cu(NO3)2 và AgNO3. Thành phần % khối lượng của hợp kim là
A. 50% Cu và 50% Ag.
B. 64% Cu và 36 % Ag.
C. 36% Cu và 64% Ag
D. 60% Cu và 40% Ag.
Đáp án B
Gọi x = nCu, y = nAg
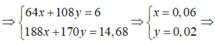
%mCu =  Đáp án B
Đáp án B
hòa tan 84 gam hỗn hợp ag và cu vào dung dịch hno3 dư, sau phản ứng thu được 8,96 lít khí NO
a) tính khối lượng mỗi kim loại trong hh ban đầu
b) tính số mol hno3 đã p/ứ và khối lượng h2o tạo thành
a)
Gọi $n_{Ag} = a ; n_{Cu} = b \Rightarrow 108a + 64b = 84(1)$
$3Ag + 4HNO_3 \to 3AgNO_3 + NO + 2H_2O$
$3Cu+ 8HNO_3 \to 3Cu(NO_3)_2 + 2NO + 4H_2O$
Theo PTHH :
$n_{NO} = \dfrac{a}{3} + \dfrac{2b}{3} = 0,4(2)$
Từ (1)(2) suy ra a = 0,6 ; b = 0,3
$m_{Ag} = 0,6.108 = 64,8(gam)$
$m_{Cu} = 0,3.64 = 19,2(gam)$
b)
$n_{HNO_3} = 4n_{NO} = 0,4.4 = 1,6(mol)$
$n_{H_2O} = \dfrac{1}{2}n_{HNO_3}= 0,8(mol)$
$m_{H_2O} = 0,8.18 = 14,4(gam)$
Cho hỗn hợp Al và Fe tác dụng với hỗn hợp dung dịch chứa AgNO 3 và Cu NO 3 2 thu được dung dịch B và chất rắn D gồm 3 kim loại. Cho D tác dụng với dung dịch HCl dư, thấy có khí bay lên. Thành phần chất rắn D là :
A. Al, Fe và Cu ; B. Fe, Cu và Ag ;
C. Al, Cu và Ag ; D. Kết quả khác.
Đáp án B.
Al là kim loại hoạt động hoá học mạnh hơn Fe nên Al phản ứng hết trước. Trường hợp 1 : Al vừa đủ phản ứng, còn Fe không phản ứng và kim loại Ag, Cu được giải phóng.
Al + 3 AgNO 3 → Al NO 3 3 + 3Ag
2Al + 3 Cu NO 3 2 → 2 Al NO 3 3 + 3Cu
Trường hợp 2 : Al phản ứng hết, sau đó đến Fe phản ứng, Fe dư và kim loại Ag, Cu được giải phóng.
Fe + 2 AgNO 3 → Fe NO 3 2 + 2Ag
Fe + Cu NO 3 2 → Fe NO 3 2 + Cu
Chất rắn D gồm Ag, Cu và Fe.
Cho hỗn hợp gồm Mg và Fe có khối lượng 8,64 gam được chia thành hai phần bằng nhau.
Phần 1: Hòa tan hoàn toàn vào dung dịch HNO3 loãng, dư thoát ra 555ml hỗn hợp khí NO và NO2 đo ở 27,3° C và 2 atm và có tỉ khối hơi so với H2 bằng 18,8889.
Phần 2: Đem hòa tan vào 400ml dung dịch chứa AgNO3 và Cu(NO3)2. Sau phản ứng thu được chất rắn gồm 3 kim loại có khối lượng 7,68g. Hòa tan chất rắn này trong dung dịch HCl dư thấy khối lượng chất rắn đã giảm đi 21,88%. Nồng độ của dung dịch AgNO3 và Cu(NO3)2 trong dung dịch lần lượt là
A.0,15M và 0,1M
B. 0,1M và 0,1M
C.0,05M và 0,15M
D. 0,125M và 0,215M
Đáp án C:
Gọi x, y là số mol Mg và Fe trong mỗi phần
=> 24x+56y = 4,32
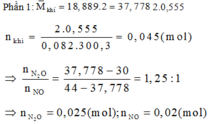

Phần 2: Gọi a, b lần lượt là số mol của AgNO3 và Cu(NO3)2
Sau phản ứng có 3 kim loại là Ag, Cu và Fe dư.
Gọi số mol Fe tham gia phản ứng là t (mol)
Bảo toàn electron ta có: nenhường= ne nhận
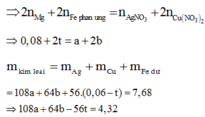
Chỉ có duy nhất Fe dư tan trong HCl
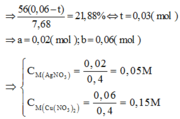
Hòa tan hết 2,36 gam hỗn hợp Ag và Cu vào dung dịch HNO3 đặc, nóng (dư) thu được 1,12 lít khí NO2 duy nhất (điều kiện tiêu chuẩn).Tính % về khối lượng mỗi kim loại trong hỗn hợp ban đầu?
Ta có: \(n_{NO_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
Theo đề bài: \(108n_{Ag}+64n_{Cu}=2,36\) (1)
Bảo toàn electron: \(n_{Ag}+2n_{Cu}=n_{NO_2}=0,05\) (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{Ag}=0,01\left(mol\right)\\n_{Cu}=0,02\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}\%m_{Ag}=\dfrac{108\cdot0,01}{2,36}\cdot100\%\approx45,76\%\\\%m_{Cu}=54,24\%\end{matrix}\right.\)
Ag + 2HNO3 ⟶ AgNO3 + H2O + NO2
Cu + 4HNO3 → Cu(NO3)2 + 2NO2↑ + 2H2O
\(n_{NO_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
Gọi x,y lần lượt là số mol Ag, Cu
Ta có : \(\left\{{}\begin{matrix}108x+64y=2,36\\x+2y=0,05\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}x=0,01\\y=0,02\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}m_{Ag}=0,01.108=1,08\left(g\right)\\m_{Cu}=0,02.64=1,28\left(g\right)\end{matrix}\right.\)
=> \(\%m_{Ag}=\dfrac{1,08}{2,36}.100=45,76\%\)
=>%mCu = 100 - 45,76 =54,24%
Số mol của khí nito đioxxit
nNO2= \(\dfrac{V_{NO2}}{22,4}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
Pt : Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O\(|\)
1 4 1 2 2
0,025 0,05
Số mol của đồng
nCu = \(\dfrac{0,05.1}{2}=0,025\left(mol\right)\)
Khối lượng của đồng
mCu = nCu . MCu
= 0,025 . 64
= 1,6 (g)
Khối lượng của bạc
mAg = 2,36 - 1,6
= 0,76 (g)
0/0 mCu= \(\dfrac{m_{Cu}.100}{m_{hh}}=\dfrac{1,6.100}{2,36}=67,8\)0/0
0/0mAg = \(\dfrac{m_{Ag}.100}{m_{hh}}=\dfrac{0,76.100}{2,36}=32,2\)0/0
Chúc bạn học tốt
Ngâm hỗn hợp A gồm 3 kim loại Fe, Ag và Cu trong dung dịch chỉ chứa chất tan B. Fe, Cu phản ứng hết nhưng lượng Ag không đổi. Chất B là:
A. AgNO3
B. Fe(NO3)3
C. Cu(NO3)2
D. HNO3
Đáp án B
Cu, Fe, Ag + dung dịch B thì sau phản ứng Fe, Cu tan còn lượng Ag không đổi thì B phản ứng được với Fe và Cu nhưng không sinh thêm Ag.
A loại vì sinh thêm Ag sau phản ứng.
B đúng
C loại vì Cu không phản ứng.
D loại vì cả 3 KL đều phản ứng.