Hòa tan hoàn toàn hỗn hợp rắn X gồm 9,4 gam K2O ; 26,1 gam Ba(NO3)2 ; 10 gam KHCO3 ;8 gam NH4NO3 vào nước dư, rồi đun nhẹ. Sau khi kết thúc phản ứng lọc bỏ kết tủa thu được dung dịch chứa a gam muối. Giá trị của a là:
A. 20,2
B. 30,3
C. 35
D. 40,4
Hòa tan hoàn toàn hỗn hợp rắn X gồm: 9,4 gam K2O; 26,1 gam Ba(NO3)2; 10,0 gam KHCO3; 8,0 gam NH4NO3. Sau khi phản ứng kết thúc, lọc bỏ kết tủa thu được dung dịch chứa a gam muối. Giá trị của a là:
A. 20,2
B. 30,3
C. 35,0
D. 40,4
Hòa tan hoàn toàn hỗn hợp rắn X gồm: 9,4g K2O ; 26,1g Ba(NO3)2; 10g KHCO3 ; 8g NH4NO3 vào nước dư, rồi đun nhẹ . Sau khi kết thúc phản ứng lọc bỏ kết tủa thu được dung dịch chứa khối lượng (gam) muối là
A. 35,0
B. 40,4
C. 20,2
D. 30,3
Hòa tan hoàn toàn hỗn hợp rắn X gồm: 9,4g K 2 O ; 26,1g B a ( N O 3 ) 2 ; 10g K H C O 3 ; 8g N H 4 N O 3 vào nước dư, rồi đun nhẹ . Sau khi kết thúc phản ứng lọc bỏ kết tủa thu được dung dịch chứa khối lượng (gam) muối là
A. 30,3
B. 35,0
C. 20,2
D. 40,4
Hòa tan hoàn toàn hỗn hợp rắn X gồm: 9,4g K2O ; 26,1g Ba(NO3)2; 10g KHCO3 ; 8g NH4NO3 vào nước dư, rồi đun nhẹ . Sau khi kết thúc phản ứng lọc bỏ kết tủa thu được dung dịch chứa khối lượng (gam) muối là
A. 35,0
B. 40,4
C. 20,2
D. 30,3
Hòa tan hoàn toàn 14,51 gam hỗn hợp X gồm K, Ba, K2O vào nước dư thì thu được 2,24 lít khí hiđro(đktc). Mặt khác đốt cháy hoàn toàn 14,51 gam hỗn hợp X trong khí oxi, thu được a gam hỗn hợp các oxit kimloại. Viết các phương trình xảy ra và tính giá trị của m.
Bảo toàn e :
nO2 = 2 .nH2 = 2 . 2,24 /22,4 = 0,2 (mol)
=> khối lượng oxit = 14,51+ 0,2 . 32 = 20,91 (g)
PT: \(2K+2H_2O\rightarrow2KOH+H_2\)
\(Ba+2H_2O\rightarrow Ba\left(OH\right)_2+H_2\)
\(4K+O_2\underrightarrow{t^o}2K_2O\)
\(2Ba+O_2\underrightarrow{t^o}2BaO\)
Giả sử: \(\left\{{}\begin{matrix}n_K=x\left(mol\right)\\n_{Ba}=y\left(mol\right)\end{matrix}\right.\)
Theo PT: \(\Sigma n_{H_2}=\dfrac{1}{2}n_K+n_{Ba}=\dfrac{1}{2}x+y\left(mol\right)\)
Mà: \(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
\(\Rightarrow\dfrac{1}{2}x+y=0,1\Rightarrow\dfrac{1}{4}x+\dfrac{1}{2}y=0,05\left(1\right)\)
Theo PT: \(\Sigma n_{O_2}=\dfrac{1}{4}n_K+\dfrac{1}{2}n_{Ba}=\dfrac{1}{4}x+\dfrac{1}{2}y\left(mol\right)\)
\(\Rightarrow\Sigma n_{O_2}=0,05\left(mol\right)\)
Theo ĐLBT KL: \(a=m_{oxit}=m_X+m_{O_2}=14,51+0,05.32=16,11\left(g\right)\)
Bạn tham khảo nhé!
Hòa tan hoàn toàn 9,4 gam K2O vào 70,6 gam nước, thu được dung dịch KOH có nồng độ x%. Giá trị của X là
A. 16.
B. 14.
C. 22.
D. 18.
Chọn đáp án C
Bình 1 tăng 2,52 ⇒ nH2O = 0,14 mol.
+ Bình 2 tăng 4,4 gam ⇒ nCO2 = 0,1 mol.
+ Nhận thấy nH2O > nCO2 ⇒ 2 CxHy thuộc dãy đồng đẳng của ankan.
⇒ nHỗn hợp ankan = 0,14 – 0,1 = 0,04 mol
⇒ C trung bình = 0,1 ÷ 0,04 = 2,5 ⇒ Chọn C
Hòa tan hoàn toàn 9,4 gam K2O vào 70,6 gam nước, thu được dung dịch KOH có nồng độ x%. Giá trị của x là
A. 14
B. 18
C. 22
D. 16
Chọn đáp án A.
n K 2 O = 9 , 4 94 = 0 , 1 m o l
![]()
![]()
→ B T K L mdung dịch sau phản ứng = 80 gam
![]()
Hòa tan hoàn toàn 9,4 gam K2O vào 70,6 gam nước, thu được dung dịch KOH có nồng độ x%. Giá trị của x là
A. 14.
B. 18
C. 22
D. 16
Hòa tan hoàn toàn 9,4 gam K2O vào 70,6 gam nước, thu được dung dịch KOH có nồng độ x%. Giá trị của x là
A. 14.
B. 18.
C. 22.
D. 16.
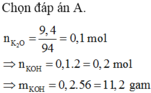
mdung dịch sau phản ứng = 9,4 + 70,6 = 80 gam
C % = 11 , 2 80 . 100 % = 14 %