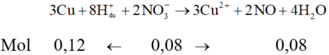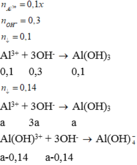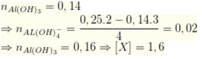Khuấy kĩ dung dịch chứa 13,60g AgNO 3 với m gam Cu rồi thêm tiếp 100ml dung dịch H 2 SO 4 loãng dư. Đun nóng tới khi phản ứng hoàn toàn thu được 9,28g kim loại và V lil khí NO. Giá trị của m và V là:
A. 10,88g và 2,6881
B. 6,4g và 2,241
C. 10,88g và 1,7921
D. 3,2g và 0,35841