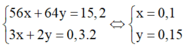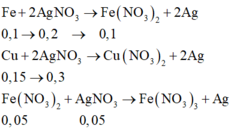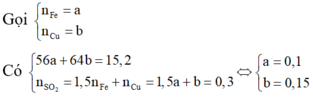Chia 30,4 gam hỗn hợp gồm Fe và Cu thành hai phần bằng nhau. Phần 1 cho tác dụng hết với dung dịch H2SO4 đặc nóng dư thu được 6,72 lít khí SO2 (sản phẩm khử duy nhất, đktc). Hòa tan phần 2 trong 550ml dung dịch AgNO3 1M, kết thúc phản ứng thu được dung dịch Y. Nồng độ mol của Fe(NO3)2 trong dung dịch Y (coi thể tích dung dịch không đổi trong quá trình xảy ra phản ứng) là
A. 0,181M.
B. 0,363M.
C. 0,182M.
D. 0,091M.