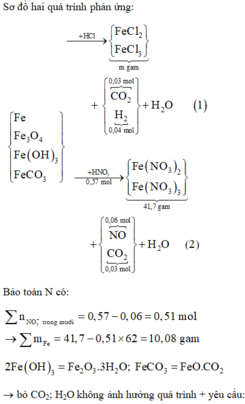
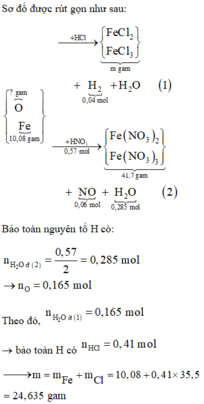
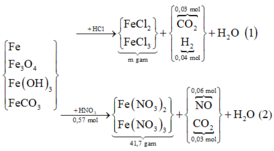
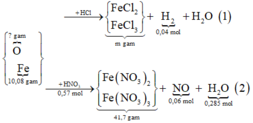
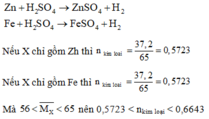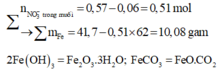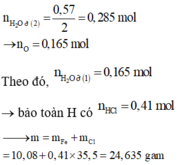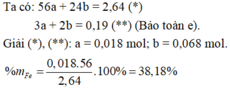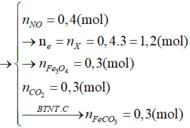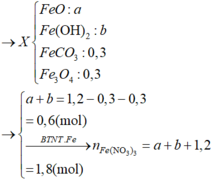Hoà tan hỗn hợp gồm FeCl 3 , Fe 2 SO 4 3 , CuCl 2 và CuSO 4 vào nước thành 200 ml dung dịch A. Điện phân 100 lít dung dịch A cho đến khi hết ion Cl - thì dừng điện phân thấy catot tăng 6,4 gam, đồng thời khối lượng dung dịch giảm 17,05 gam. Dung dịch sau điện phân phản ứng với NaOH vừa đủ thu được kất tủa B, nung B trong không khí đến khối lượng không đổi thu được 16 gam hỗn hợp hai oxit kim loại, cô cạn 100 ml dung dịch A thu được m gam hỗn hợp muối khan. Giá trị của m là :
A. 48,25
B. 57,85
C. 67,45
D. 38,65