Một bình chứa một lượng khí ở nhiệt độ 30 ° C và áp suất 2 bar. ( 1 b a r = 10 5 P a ). Hỏi phải tăng nhiệt độ lên tới bao nhiêu độ để áp suất tăng gấp đôi ? Xem thể tích bình chứa luôn không đổi.
A. 333 ° C
B. 606 ° C
C. 60 ° C
D. 303 ° C
Một bình chứa một lượng khí ở nhiệt độ 30 độ C và áp suất 2 bar ( 1 bar = 105 Pa ) . Hỏi phải tăng nhiệt độ lên tới bao nhiêu độ để áp suất tăng gấp đôi.
Ta có : T1 = toC + 273 = 30 + 273 = 303oK
p1 = 2 bar = 2 . 105 Pa
p2 = 4 bar = 4 . 105
Vì quá trình là đẳng tích , áp dụng định luật Charles ta có
\(\frac{p_1}{p_2}=\frac{T_1}{T_2}\)→ T2 = \(\frac{p_2.T_1}{p_1}=\frac{4.10^5.303}{2.10^5}\)= 606oK
Vậy để áp suất tăng lên gấp đôi , ta phải tăng nhiệt độ lên 606oK
* Trạng thái 1: T1 = 273 + 30 = 303 K
p1 = 2 bar
* Trạng thái 2: T2 = ? p2 = 2p1
* Vì thể tích bình không đổi nên:
\(\frac{P1}{T1}=\frac{P2}{T2}\Rightarrow T2=\frac{P2.T1}{P1}=\frac{2P1.T1}{P1}\) = 2T1 = 606 K
Một bình chứa một lượng khí ở nhiệt độ 30oC và áp suất 2 bar. (1 bar = 105 Pa). Hỏi phải tăng nhiệt độ lên tới bao nhiêu độ để áp suất tăng gấp đôi?
Bài giải:
* Trạng thái 1: T1 = 273 + 30 = 303 K
p1 = 2 bar
* Trạng thái 2: T2 = ? p2 = 2p1
* Vì thể tích bình không đổi nên:
\(\dfrac{p_1}{T_1}=\dfrac{p_2}{T_2}\Rightarrow T_2=\dfrac{p_2.T_1}{p_1}=\dfrac{2p_1.T_1}{p_1}=2T_1=606k\)
một lượng chứa một lượng khí ở nhiệt độ 30oC và áp suất 2 bar . (1 bar = 105 Pa) . Hỏi phải tăng nhiệt độ lên tới bao nhiêu độ để áp suất tăng gấp đôi ?
t = 30*C => T = 303K
Quá trình đẳng tích thì áp suất tỉ lệ thuận với nhiệt độ.
Áp suất tăng gấp đôi thì nhiệt độ tăng gấp đôi => T' = 2T = 606K
=> t' = 606 - 273 = 333*C
Một bình chứa một lượng khí ở nhiệt độ 30o C và áp suất 2 bar. (1 bar = 105 Pa). Hỏi phải tăng nhiệt độ lên tới bao nhiêu độ để áp suất tăng gấp đôi?
Trạng thái 1: T1 = t1 + 273 = 303 K; P1 = 2 bar
Trạng thái 2: P2 = 4 bar ; T2 = ?
Áp dụng định luật Sác-lơ cho quá trình biến đổi đẳng tích, ta có:
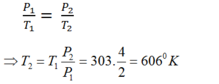
Một bình chứa 1 lượng khí ở nhiệt độ 30ºC và áp suất là 2.10^5 pa. Biết thể tích khí không đổi a) Hỏi phải tăng nhiệt độ lên đến bao nhiêu độ ( K ) để áp suất tăng gấp đôi b) Hỏi nếu giảm nhiệt độ xuống bao nhiêu độ C để áp suất giảm còn một nữa giúp với ạ :>
\(a,\dfrac{p_1}{T_1}=\dfrac{p_2}{T_2}\Rightarrow T_2=\dfrac{T_1p_2}{p_1}=\dfrac{303.4.10^5}{2.10^5}=606^oK\\ b,T_2=\dfrac{303.10^5}{2.10^5}=151,5^oK\)
Một bình có dung tích V = 10 lít chứa một lượng khí hiđrô bị nén ở áp suất p = 50atm và nhiệt độ 7 ° . Khi nung nóng bình, do bình hờ nên có một phần khí thoát ra; phần khí còn lại có nhiệt độ 17 ° C và vẫn dưới áp suất như cũ. Tính khối lượng khí đã thoát ra.
Gọi m i , rrn là khối lượng khí trong bình trước và sau khi nung nóng bình.
Áp dụng phương trình Menđêlêep - Clapêrôn ta có:
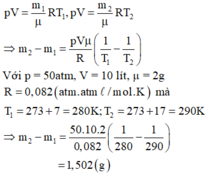
Một bình chứa kín một chất khí ở nhiệt độ 57 ° C và áp suất 30atm. Người ta cho 2/3 lượng khí thoát ra khỏi bình và hạ nhiệt độ xuống còn 41 ° C . Tính áp suất của khí còn lại trong bình. Coi thể tích của bình chứa không thay đổi khi hạ nhiệt độ. Chọn đáp án đúng.
A. 6,98 atm
B. 10,1 atm
C. 7,66 atm
D. 5,96 atm
Chọn B.
Ban đầu, lúc chưa làm thoát khí ta có:
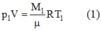
Khi làm thoát khí, lượng khí còn lại trong bình là
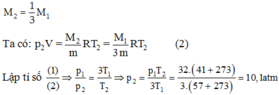
Một bình chứa một lượng khí ở nhiệt độ 27 ° C và áp suất 40 atm. Nếu giảm nhiệt độ xuống tới 12C và để một nửa lượng khí thoát ra ngoài thì áp suất khí còn lại trong bình sẽ bằng bao nhiêu ?
Xét lượng khí còn lại trong bình
Trạng thái 1: V 1 = V/2; T 1 = 27 + 273 = 300 K; p 1 = 40 atm.
Trạng thái 2: V 2 = V; T 2 = 12 + 273 = 285 K; p 2 = ? atm,
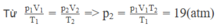
Một bình chứa kín một chất khí ở nhiệt độ 57°C và áp suất 30atm. Người ta cho 2/3 lượng khí thoát ra khỏi bình và hạ nhiệt độ xuống còn 41 o C . Tính áp suất của khí còn lại trong bình. Coi thể tích của bình chứa không thay đổi khi hạ nhiệt độ. Chọn đáp án đúng.
A. 6,98 atm
B. 10,1 atm
C. 7,66 atm
D. 5,96 atm