Cho 5,56g hỗn hợp A gồm Fe và kim loại M ( hóa trị n). Chia A ra làm 2 phần bằng nhau.
P1: cho tác dụng với HCl thu được 1,568l khí H2
P2:cho tác dụng với H2SO4 đặc nóng thu được 2,016l khí SO2
Viết các phương trình phản ứng và xác định tên kim loại M biết các khí đều đo ở đktc.

Những câu hỏi liên quan
Cho 5,56g hỗn hợp A gồm Fe và kim loại M ( hóa trị không đổi) . Chia A thành 2 phần bằng nhau
Phần 1 : Hòa tan hết trong dd HCl được 1,568 lít khí H2(đktc)
Phần 2 : Tác dụng vừa đủ với 2,016 lít khí Cl2 ( đktc) . Xác định kim loại M? Giúp mình vớii
Gọi: \(\left\{{}\begin{matrix}n_{Fe}=x\left(mol\right)\\n_M=y\left(mol\right)\end{matrix}\right.\) (trong 1 phần) ⇒ 56x + MM.y = 5,56:2 (1)
Giả sử M có hóa trị n không đổi.
- Phần 2: \(n_{Cl_2}=\dfrac{2,016}{22,4}=0,09\left(mol\right)\)
PT: \(2Fe+3Cl_2\underrightarrow{t^o}2FeCl_3\)
\(2M+nCl_2\underrightarrow{t^o}2MCl_n\)
Theo PT: \(n_{Cl_2}=\dfrac{3}{2}n_{Fe}+\dfrac{n}{2}n_M=\dfrac{3}{2}x+\dfrac{n}{2}y=0,09\left(2\right)\)
- Phần 1: \(n_{H_2}=\dfrac{1,568}{22,4}=0,07\left(mol\right)\)
+ TH1: M có pư với HCl.
PT: \(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(2M+2nHCl\rightarrow2MCl_n+nH_2\)
Theo PT: \(n_{H_2}=n_{Fe}+\dfrac{n}{2}n_M=x+\dfrac{n}{2}y=0,07\left(3\right)\)
Từ (2) và (3) \(\Rightarrow\left\{{}\begin{matrix}x=0,04\left(mol\right)\\ny=0,06\end{matrix}\right.\)
Thay vào (1), ta được: \(M_M.y=0,54\) \(\Rightarrow\dfrac{M_M.y}{n.y}=\dfrac{0,54}{0,06}\Rightarrow M_M=9n\)
Với n = 3 thì MM = 27 (g/mol) là thỏa mãn.
→ M là Al.
+ TH2: M không pư với HCl.
PT: \(Fe+2HCl\rightarrow FeCl_2+H_2\)
Theo PT: \(x=n_{Fe}=n_{H_2}=0,07\left(mol\right)\)
Thay vào (1) ta được \(M_M.y=-1,14\) (vô lý vì MM và y đều là số dương)
Vậy: M là Al.
Đúng 2
Bình luận (0)
Cho 10.8 gam hỗn hợp A gồm Cu và kim loại M (khối lượng của M lớn hơn khối lượng của Cu) tác dụng với dung dịch HCl dư, thu dược 2,912 lít khí (đktc). Nếu cho hỗn hợp A này tác dụng hết với dung dịch H2SO4 đặc, đun nóng thì thu được 5,6 lít khí SO2 (sản phẩm khử duy nhất, đktc). Mặt khác, nếu cho 5,4 gam hỗn hợp A tác dụng với 160 ml AgNO3 1M thu được m gam chắt rắn. Biết các phản ứng xảy ra hoàn toàn, kim loại M không có hóa trị (I) trong các hợp chất. Xác định giá trị m
Đọc tiếp
Cho 10.8 gam hỗn hợp A gồm Cu và kim loại M (khối lượng của M lớn hơn khối lượng của Cu) tác dụng với dung dịch HCl dư, thu dược 2,912 lít khí (đktc). Nếu cho hỗn hợp A này tác dụng hết với dung dịch H2SO4 đặc, đun nóng thì thu được 5,6 lít khí SO2 (sản phẩm khử duy nhất, đktc). Mặt khác, nếu cho 5,4 gam hỗn hợp A tác dụng với 160 ml AgNO3 1M thu được m gam chắt rắn. Biết các phản ứng xảy ra hoàn toàn, kim loại M không có hóa trị (I) trong các hợp chất. Xác định giá trị m
nH2 = 0,13 mol; nSO2 = 0,25 mol
Ta có
2H+ + 2e → H2 Cu → Cu2+ + 2e
0,26 ←0,13 0,12 0,24
S+6 + 2e → S+4
0,5 ← 0,25
TH1: M là kim loại có hóa trị không đổi
=> nCu = (0,5 – 0,26) : 2 = 0,12 mol => mCu = 7,68g
=> mM = 3,12g (loại vì khối lượng của M lớn hơn của Cu)
TH2: M là kim loại có hóa trị thay đổi
Do M không có hóa trị I do đó khi phản ứng với HCl thì M thể hiện hóa trị II
M + 2HCl → MCl2 + H2
0,13 ← 0,13
Do M có hóa trị thay đổi => khi phản ứng với H2SO4 đặc nóng thì M thể hiện hóa trị III
2M + 6H2SO4 → M2(SO4)3 + 3SO2 + 6H2O
0,13 → 0,195
Cu + 2H2SO4 → CuSO4+ SO2 + 2H2O
0,055 ← 0,055
=> mM = 10,8 – 0,055 . 64 = 7,28g
=> MM = 56 => Fe
Ta có số mol của Cu và Fe trong 10,8 g lần lượt là 0,055 và 0,13 mol
=> Trong 5,4g có số mol Cu và Fe lần lượt là 0,0275 và 0,065 mol
nAgNO3 = 0,16mol
Fe + 2AgNO3 → Fe(NO3)2 +2Ag
0,065 0,13 0,065 0,13
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
0,015 0,03 0,03
=> nCu dư = 0,0275 – 0,015 = 0,0125mol
m = mCu dư + mAg = 0,0125 . 64 + 0,16 . 108 = 18,08g
Đúng 1
Bình luận (0)
Cho m gam hỗn hợp 2 kim loại Al và Cu chia làm 2 phần bằng nhau :- Phần 1 : Cho tác dụng với dung dịch
H
2
SO
4
loãng, dư thu được 1,344 lít khí
H
2
(đktc).- Phần 2 : Cho tác dụng với dung dịch
H
2
SO...
Đọc tiếp
Cho m gam hỗn hợp 2 kim loại Al và Cu chia làm 2 phần bằng nhau :
- Phần 1 : Cho tác dụng với dung dịch H 2 SO 4 loãng, dư thu được 1,344 lít khí H 2 (đktc).
- Phần 2 : Cho tác dụng với dung dịch H 2 SO 4 đặc nóng, dư, thu được 2,24 lít khí SO 2 (đktc) .Xác định giá trị của m.
Các PTHH :
2Al + 3 H 2 SO 4 → Al 2 SO 4 3 + 3 H 2 (1)
2Al + 6 H 2 SO 4 → Al 2 SO 4 3 + 3 SO 2 + 6 H 2 O (2)
Cu + 2 H 2 SO 4 → Cu SO 4 + 2 H 2 O + SO 2 (3)
Theo PTHH (1) số mol Al tham gia phản ứng bằng 2/3 số mol H 2 => Khối lượng AI trong hỗn hợp : 2×2/3×0,06×27 = 2,16(g)
Số mol SO 2 được giải phóng bởi Al: 2,16/27 x 3/2 = 0,12 mol
Theo PTHH (2) và (3) số mol SO 2 giải phóng bởi Cu : 2.0,1 - 0,12 = 0,08 (mol)
Theo PTHH (3) khối lượng Cu trong hỗn hợp : 0,08. 64 = 5,12 (g)
Vậy m = 2,16 + 5,12 = 7,28 (g).
Đúng 0
Bình luận (0)
Chia m gam hỗn hợp X gồm Fe và Ag thành 2 phần bằng nhau Phần 1: Cho tác dụng với dung dịch HCl dư thu được 2,24l H2 Phần 2: Cho tác dụng với dung dịch H2SO4 đặc, dư ở điều kiện thường thu được 3,36l SO2. Khi không thấy khí thoát ra nữa, đun nóng hỗn hợp phản ứng thu được V lít SO2 a, Viết phương trình phản ứng xảy ra b, Tính m(biết các thể tích khí thoát ra được do ở điều kiện tiêu chuẩn, SO2 là sản phẩm khử duy nhất của các phản ứng ở phần 2)
Đọc tiếp
Chia m gam hỗn hợp X gồm Fe và Ag thành 2 phần bằng nhau
Phần 1: Cho tác dụng với dung dịch HCl dư thu được 2,24l H2
Phần 2: Cho tác dụng với dung dịch H2SO4 đặc, dư ở điều kiện thường thu được 3,36l SO2. Khi không thấy khí thoát ra nữa, đun nóng hỗn hợp phản ứng thu được V lít SO2
a, Viết phương trình phản ứng xảy ra
b, Tính m(biết các thể tích khí thoát ra được do ở điều kiện tiêu chuẩn, SO2 là sản phẩm khử duy nhất của các phản ứng ở phần 2)
Hỗn hợp X gồm Fe và Cu. Chia m gam hỗn hợp X thành 2 phần bằng nhau. Phần 1 cho tác dụng với dung dịch HCl dư, thấy thoát ra 2,24 lít khí (đktc). Phần 2 cho tác dụng với dung dịch H2SO4 đặc, nóng dư thu được 8,96 lít SO2 (sản phẩm khử duy nhất, đktc). Giá trị của m là A. 38,4. B. 26,4 C. 43,2 D. 21,6.
Đọc tiếp
Hỗn hợp X gồm Fe và Cu. Chia m gam hỗn hợp X thành 2 phần bằng nhau. Phần 1 cho tác dụng với dung dịch HCl dư, thấy thoát ra 2,24 lít khí (đktc). Phần 2 cho tác dụng với dung dịch H2SO4 đặc, nóng dư thu được 8,96 lít SO2 (sản phẩm khử duy nhất, đktc). Giá trị của m là
A. 38,4.
B. 26,4
C. 43,2
D. 21,6.
Chọn C
Phần 1 chỉ có Fe phản ứng → nFe = nH2 = 0,1
Phần 2 có cả Fe và Cu phản ứng, mà H2SO4 đặc dư → Fe lên Fe3+ hết
BTE → 3nFe + 2nCu = 2x 0,4 → nCu = (0,8 – 0,3)/2 = 0,25
Vậy 0,5m = 0,1 x 56 + 0,25 x 64 = 21,6 → m = 43,2.
Đúng 0
Bình luận (1)
Chia m gam hỗn hợp A gồm hai kim loại Cu, Fe thành hai phần bằng nhau. - Phần 1: tác dụng hoàn toàn với HNO3 đặc nguội thu được 0,672 lít khí. - Phần 2: tác dụng hoàn toàn với dung dịch H2SO4 loãng dư thu được 0,448 lít khí. Giá trị của m là (biết các thể tích khí được đo ở đktc): A. 4,96 gam. B. 8,80 gam C. 4,16 gam. D. 17,6 gam.
Đọc tiếp
Chia m gam hỗn hợp A gồm hai kim loại Cu, Fe thành hai phần bằng nhau.
- Phần 1: tác dụng hoàn toàn với HNO3 đặc nguội thu được 0,672 lít khí.
- Phần 2: tác dụng hoàn toàn với dung dịch H2SO4 loãng dư thu được 0,448 lít khí.
Giá trị của m là (biết các thể tích khí được đo ở đktc):
A. 4,96 gam.
B. 8,80 gam
C. 4,16 gam.
D. 17,6 gam.
Đáp án C
P1 : Chỉ có Cu phản ứng được với HNO3 đặc nguội
Bảo toàn e : 2nCu = nNO2 = 0,03 mol
P2 : Chỉ có Fe phản ứng với H2SO4 loãng dư
=> nFe = nH2 = 0,02 mol
=> m = 2. (0,015.64 + 0,02.56) = 4,16g
Đúng 0
Bình luận (0)
Chia m gam hỗn hợp A gồm hai kim loại Cu, Fe thành hai phần bằng nhau. - Phần 1: tác dụng hoàn toàn với HNO3 đặc nguội thu được 0,672 lít khí. - Phần 2: tác dụng hoàn toàn với dung dịch H2SO4 loãng dư thu được 4,48 lít khí. Giá trị của m là (biết các thể tích khí được đo ở đktc) A. 4,96 gam B. 8,80 gam C. 4,16 gam D. 17,6 gam
Đọc tiếp
Chia m gam hỗn hợp A gồm hai kim loại Cu, Fe thành hai phần bằng nhau.
- Phần 1: tác dụng hoàn toàn với HNO3 đặc nguội thu được 0,672 lít khí.
- Phần 2: tác dụng hoàn toàn với dung dịch H2SO4 loãng dư thu được 4,48 lít khí.
Giá trị của m là (biết các thể tích khí được đo ở đktc)
A. 4,96 gam
B. 8,80 gam
C. 4,16 gam
D. 17,6 gam
Chọn đáp án C
Phần 1: tác dụng với HNO3 đặc, nguội ⇒ Fe không phản ứng, sản phẩm khử là NO2 (do dùng HNO3 đặc).
⇒ Bảo toàn electron có: 2nCu = nNO2 = 0,03 mol ⇒ nCu = 0,015 mol.
Phần 2: tác dụng với H2SO4 loãng ⇒ Cu không phản ứng, chỉ có Fe phản ứng:
Fe + H2SO4 → FeSO4 + H2↑ ||⇒ nFe = 0,02 mol.
Theo đó, m = 2 × (0,015 × 64 + 0,02 × 56) = 4,16 gam (tránh quên × 2 do chia đôi)
Đúng 0
Bình luận (0)
Chia m gam hỗn hợp A gồm hai kim loại Cu, Fe thành hai phần bằng nhau. - Phần 1: tác dụng hoàn toàn với HNO3 đặc nguội thu được 0,672 lít khí. - Phần 2: tác dụng hoàn toàn với dung dịch H2SO4 loãng dư thu được 4,48 lít khí. Giá trị của m là (biết các thể tích khí được đo ở đktc): A. 4,96 gam B. 8,80 gam C. 4,16 gam D. 17,6 gam
Đọc tiếp
Chia m gam hỗn hợp A gồm hai kim loại Cu, Fe thành hai phần bằng nhau.
- Phần 1: tác dụng hoàn toàn với HNO3 đặc nguội thu được 0,672 lít khí.
- Phần 2: tác dụng hoàn toàn với dung dịch H2SO4 loãng dư thu được 4,48 lít khí.
Giá trị của m là (biết các thể tích khí được đo ở đktc):
A. 4,96 gam
B. 8,80 gam
C. 4,16 gam
D. 17,6 gam
Phần 1: tác dụng với HNO3 đặc, nguội ⇒ Fe không phản ứng, sản phẩm khử của N + 5 là NO2 (do dùng HNO3 đặc).
⇒ Bảo toàn electron có: 2nCu = n NO 2 = 0,03 mol
⇒ nCu = 0,015 mol.
Phần 2: tác dụng với H2SO4 loãng ⇒ Cu không phản ứng, chỉ có Fe phản ứng:
Fe + H2SO4 → FeSO4 + H2↑
⇒ nFe = n H 2 = 0,02 mol.
Theo đó, m = 2 × (0,015 × 64 + 0,02 × 56) = 4,16 gam
Đáp án C
Đúng 0
Bình luận (0)
Chia m gam hỗn hợp X gồm hai kim loại Cu, Fe thành hai phần bằng nhau.Phần 1: Tác dụng hoàn toàn với
HNO
3
đặc, nguội thu được 2,24 khí
NO
2
(đktc).Phần 2: Tác dụng hoàn toàn với dung dịch
H
2
SO
4
loãng, dư thu được 4,48 lít khí (đktc) Giá trị của m là (Cho Cu 64; Fe 56) A. 4,96. B. 28,8. C. 4,16. D. 17,6.
Đọc tiếp
Chia m gam hỗn hợp X gồm hai kim loại Cu, Fe thành hai phần bằng nhau.
Phần 1: Tác dụng hoàn toàn với HNO 3 đặc, nguội thu được 2,24 khí NO 2 (đktc).
Phần 2: Tác dụng hoàn toàn với dung dịch H 2 SO 4 loãng, dư thu được 4,48 lít khí (đktc) Giá trị của m là (Cho Cu = 64; Fe = 56)
A. 4,96.
B. 28,8.
C. 4,16.
D. 17,6.
Chọn B
Phần I. Cho X tác dụng với HNO 3 đặc, nguội chỉ có Cu phản ứng.
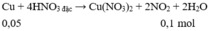
Phần II. Cho X tác dụng với H 2 SO 4 loãng, dư chỉ có Fe phản ứng
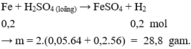
Đúng 0
Bình luận (0)







