Cho x mol N2 và 12 mol H2 vào bình kín. Tại thời điểm cân bằng thấy có 6 mol NH3 tạo thành. Biết hiệu suất chung của phản ứng là 75%. Tìm x?
A. x>1
B. x>2
C. x>3
D. x≥4
cho X mol N2 và 12 mol H2 vào bình kín dung tích 10 lít , tại thời điểm cân = thấy có 6 mol NH3 tạo thành . biết hiệu suất chung của phản ứng là 60%
a\ tìm X
b\tính hằng số cân =
Một bình kín có thể tích 0,5 lít chứa 0,5 mol H2 và 0,5 mol N2 ở nhiệt độ thích hợp, khi đạt tới trạng thái cân bằng có 0,2 mol NH3 được tạo thành. Hiệu suất của phản ứng là bao nhiêu?
A. 20%
B. 30%
C. 60%
D. 50%
Đáp án C.
N2+ 3H2 ⇌ 2NH3
Vì  nên hiệu suất tính theo H2
nên hiệu suất tính theo H2
N2+ 3H2 ⇌ 2NH3
Ban đầu 0,5 0,5 mol
Phản ứng x/3 x 2x/3 mol
Sau pứ 0,2 mol
Ở trạng thái cân bằng có 0,2 mol NH3 tạo thành nên 2x/3= 0,2
→x=0,3

Phản ứng tổng hợp ammonia: N2(g) + 3H2(g) t o , x t , p ⇌ 2NH3(g) trong bình kín dung dịch 2 lít chứa 0,6 mol N2 và 1,6 mol H2 phản ứng đạt trạng thái cân bằng sau 2 phút ở trạng thái cân bằng tỉ số mol giữa NH3 với tổng số mol N2 và H2 là 4/7 .A) Tính số Kc của phản ứng
trong một bình kín chứa 500 mol hỗn hợp gồm N2 và H2 theo tỉ lệ số mol là 1:4. Với điều kiện thích hợp 2 khí trên phản ứng tạo thành 50 mol NH3. Tính hiệu suất phản ứng tạo thành NH3
ban đầu nN2+ nH2=500 và nN2/nH2=1/4
=>nN2=100 mol và nH2=400 mol
N2 + 3H2 ---> 2NH3
ban đầu 100 400 0
phản ứng x 3x 2x
sau phản ứng (100-x ) ( 400-3x) 2x
lại có 50=2x=> x=25 => H%=( 25/100). 100%=25%.
trong một bình kín chứa 500 mol hỗn hợp gồm N2 và H2 theo tỉ lệ số mol là 1:4. Với điều kiện thích hợp 2 khí trên phản ứng tạo thành 50 mol NH3. Tính hiệu suất phản ứng tạo thành NH3
1) N2 + 3H2 ------> 2NH3
x -------> 3x -----------> 2x
theo tỉ lệ đề bài chon n(N2) = 1 mol và n(H2) = 3 mol
gọi x là số mol N2 tham gia pứ
ta có pt đại số theo tỉ khối là:
M(A)/MB) = 0,6 <=> (m/4)/(1 - x + 3 - 3x + 2x) = 0,6 (m: khối lượng của hỗn hợp)
=> x = 0,8
H% = 0,8/1 *100 = 80%
2) ( Bạn đã cho thiếu đề rồi. Bây giờ tôi sẽ thêm vào 10 lit H2)
N2 + 3H2 ------> 2NH3
ban đầu nN2+ nH2=500 và nN2/nH2=1/4
=>nN2=100 mol và nH2=400 mol
N2 + 3H2 ---> 2NH3
ban đầu 100 400 0
phản ứng x 3x 2x
sau phản ứng (100-x ) ( 400-3x) 2x
lại có 50=2x=> x=25 => H%=( 25/100). 100%=25%.
Xét cân bằng trong bình kín có dung tích không đổi: X(khí) <=> 2Y(khí)
Ban đầu cho 1 mol khí X vào bình, khi đạt đến trạng thái cân bằng thì thấy: Tại thời điểm ở 350C trong bình có 0,730 mol X; Tại thời điểm ở 450C trong bình có 0,623 mol X. Có các phát biểu sau về cân bằng trên:
1. Phản ứng thuận là phản ứng thu nhiệt.
2. Khi tăng áp suất, cân bằng chuyển dịch theo chiều nghịch.
3. Thêm tiếp Y vào hỗn hợp cân bằng thì làm cho cân bằng chuyển dịch theo chiều nghịch.
4. Thêm xúc tác thích hợp vào hỗn hợp cân bằng thì cân bằng vẫn không chuyển dịch.
Trong các phát biểu trên, số phát biểu đúng là
A. 2.
B. 1.
C. 3.
D. 4.
Đáp án D
+ Khi tăng nhiệt độ cân bằng dịch phải (số mol X ít đi) → phản ứng thuận là thu nhiệt.
(1). Đúng, theo giải thích trên.
(2). Đúng, theo nguyên lý chuyển dịch cân bằng.
(3). Đúng, theo nguyên lý chuyển dịch cân bằng.
(4). Đúng, chất xúc tác chỉ ảnh hưởng tới tốc độ phản ứng chứ không ảnh hưởng tới chuyển dịch cân bằng.
Trong một bình kín chứa 4 mol khí H2 và 2 mol khí N2 và một ít bột Ni làm xúc tác. Nung nóng bình trong một thời gian thì thu được hỗn hợp khí A.a/ Nếu hiệu suất phản ứng đạt 75% thì có bao nhiêu lít khí NH3 tạo thành (đktc) .b/ Nếu tổng số mol các khí trong hỗn hợp A là 4,5 mol thì có bao nhiêu % số mol H2 bị oxi hoá thành NH3.
\(N_2+3H_2\rightarrow2NH_3\)
So sánh:
\(\dfrac{n_{N_2}}{1}=2>\dfrac{n_{H_2}}{3}=1,333\)
-> Tính theo H2
\(n_{H_2}pư=75\%.4=3\left(mol\right)\)
\(\rightarrow n_{NH_3}=2\left(mol\right)\)
\(\rightarrow V_{NH_3}=2.22,4=44,8\left(l\right)\)
b. \(N_2+3H_2\rightarrow2NH_3\)
Bđ : 2 ..... 4 ..........
Pứ : a ....... 3a ........ 2a
Sau: (2-a) : (4-3a) : 2a
2-a+4-3a+2a = 4,5
=> a = 0,75 (mol)
%nH2 bị oxh = \(\dfrac{3.0,75}{4}.100\%=56,25\%\)
Cho V lít (đktc) hỗn hợp N2 và H2 có tỉ lệ mol 1:4 vào bình kín và đun nóng. Sau phản ứng thu được 1,5 mol NH3. Biết hiệu suất phản ứng là H= 25%. Giá trị của V là:
A. 42 lít
B. 268,8 lít
C. 336 lít
D. 448 lít
Đáp án B
![]()
Do 1 1 > 4 3 → Hiệu suất tính theo N 2
Đặt số mol N2 ban đầu là x mol
→ nH2 ban đầu= 4x mol;
Do hiệu suất phản ứng là 25% nên
nN2 pứ= 25%.x= 0,25x mol
![]()
Ban đầu x 4x mol
Phản ứng 0.25x 0.75x 0.5x mol
Sau pứ 0.75x 3.25x 0.5x mol
Sau phản ứng nNH3= 0,5x= 1,5 suy ra x=3 mol
→V= 22,4. (x+3x)= 22,4.4.3=268,8 lít
Cho V lít (đktc) hỗn hợp khí N 2 và H 2 có tỉ lệ mol 1:4 vào bình kín và nung nóng. Sau phản ứng thu được 1,5 mol NH 3 . Biết hiệu suất phản ứng là H = 25%. Giá trị của V là
A. 42 lít.
B. 268,8 lít.
C. 336 lít.
D. 448 lít.
Chọn C
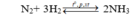
Giả sử phản ứng xảy ra với H = 100% → N 2 hết →Hiệu suất tính theo N 2 .
Đặt số mol N 2 ban đầu là x mol, n N 2 ban đầu = 4x mol;
Do hiệu suất phản ứng là 25% nên n N 2 pứ = 25%.x = 0,25x mol