Khối lượng KMnO4 cần thiết để tác dụng hết với 0,15 mol FeCl2 (trong môi trường H2SO4) là
A. 14,22 gam
B. 4,74 gam
C. 9,48 gam
D. 7,11 gam
Khối lượng KMnO4 cần thiết để tác dụng hết với 0,15 mol FeCl2 (trong môi trường H2SO4) là
A. 14,22 gam.
B. 4,74 gam.
C. 9,48 gam.
D. 7,11 gam.
Đáp án A
10FeCl2 + 6KMnO4 + 24H2SO4 → 5Fe2(SO4)3 + 3K2SO4 + 6MnSO4 + 10Cl2 + 24H2O
0,15 → 0,09
m K M n O 4 = 0,09.158 = 14,22 gam
Khối lượng KMnO4 cần thiết để tác dụng hết với 0,15 mol FeCl2 (trong môi trường H2SO4) là
A. 14,22 gam.
B. 4,74 gam.
C. 9,48 gam.
D. 7,11 gam.
Đáp án A
10FeCl2 + 6KMnO4 + 24H2SO4 → 5Fe2(SO4)3 + 3K2SO4 + 6MnSO4 + 10Cl2 + 24H2O
0,15 → 0,09
![]()
Một lượng FeCl2 tác dụng được tối đa với 9,48 gam KMnO4 trong H2SO4 loãng dư thu được dung dịch X. Cô cạn X được m gam muối khan. Xác định m:
A. 34,28
B. 45,48
C. 66,78
D. 20,00
Đốt cháy m gam Fe trong khí Clo thu được chất rắn A. Hoà tan A vào nước dư thu được dung dịch B và 2,8 gam chất rắn không tan. Cho B tác dụng với lượng dư dung dịch KMnO4 trong môi trường H2SO4, thì thấy có 0,18 mol KMnO4 tham gia phản ứng. Phần trăm khối lượng Fe tham gia phản ứng với Clo là
Mọi người giúp e với ạ...e cảm ơn
\(Fe^{2+} \to Fe^{3+} + 1e\\ Mn^{+7} + 5e \to Mn^{2+}\\ \Rightarrow n_{Fe^{2+}} = 5n_{KMnO_4} = 0,18.5 =0,9(mol)\\ 2FeCl_3 + Fe \to 3FeCl_2\\ n_{FeCl_3} = \dfrac{2}{3}n_{FeCl_2} = 0,6(mol)\\ n_{Fe\ pư} = \dfrac{1}{3}n_{Fe} = 0,3(mol)\\ \Rightarrow m_{Fe\ trong\ A} = 2,8 + 0,3.56 = 19,6(gam)\\ 2Fe + 3Cl_2 \xrightarrow{t^o} 2FeCl_3\\ n_{Fe} = n_{FeCl_3} = 0,6(mol)\\\)
Phần trăm khối lượng Fe tham gia phản ứng là : \(\dfrac{0,6.56}{0,6.56 + 19,6}.100\% = 63,15\%\)
Cho KI tác dụng với K M n O 4 trong môi trường H 2 S O 4 , thu được 1,51 gam M n S O 4 . Số mol I 2 tạo thành và KI tham gia phản ứng là
A. 0, 025 và 0,050
B. 0,030 và 0,060
C. 0,050 và 0,100
D. 0,050 và 0,050
Chọn A
Số mol MnSO4 = 0,01 mol
Ta có các quá trình:
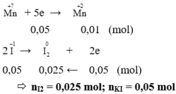
A và B là hai chất hữu cơ đồng phân của nhau (chứa C, H, O) trong đó oxi chiếm 21,621% khối lượng. Biết A, B là các hợp chất đơn chức và phản ứng được với dd NaOH. Khi cho 0,74 gam mỗi chất trên tác dụng hết với dd brom trong dung môi CCl4 thì mỗi chất tạo ra một sản phẩm duy nhất và đều có khối lượng là 1,54gam. Cho 2,22 gam hỗn hợp X gồm A và B tác dụng với dd NaHCO3 dư được 112ml khí đktc. Lấy 4,44 gam hỗn hợp X cho tác dụng với dd NaOH vừa đủ, sau đó cô cạn được 4,58 gam muối khan. Mặt khác, đun nóng hỗn hợp X với dd KMnO4 và H2SO4 cho hỗn hỗn hợp sản phẩm chỉ gồm CO2, MnSO4, K2SO4, H2O và chất D (C7H6O2). Viết công thức cấu tạo các chất A, B và viết các phản ứng của chúng với dd KMnO4 /H2SO4.
Do A, B là hợp chất hữu cơ đơn chức, có khả năng tác dụng với NaOH
=> trong phân tử A,B chứa 2 nguyên tử oxi
=> MA = MB = 32 . 100/21,621= 148 g/mol
=> CTPT của A,B là C9H8O2 .
TN1: nA + nB = 0,74/148=5.10-3
Mà m sản phẩm=1,54
=> cả A,B đều có khả năng tham gia phản ứng cộng với dung dịch Br2 theo tỉ lệ mol 1:1
=> A,B chứa 1 nối đôi C=C trong phân tử ( không phải este của phenol)
TN5: Do A,B bị oxi hóa bởi KMnO4 tạo ra C7H8O2 và CO2 => A,B chứa vòng benzen
TN2: nA + nB= 2,22/148=0,015 mol
Do hỗn hợp X có khả năng tác dụng với NaHCO3 => hỗn hợp có chứa axit
=> naxit= nCO2 = 5.10-3 => neste= 0,01 mol
TN3: trong 4,44 gam hỗn hợp naxit = 0,01 mol, neste= 0,02
=> mmuối sinh ra từ este = 4,58 – 0,01 . MC8H7COONa= 2,88
=> Mmuối sinh ra từ este = 144 g/mol.
=> CT muối sinh ra từ este là: C6H5COONa
=> CTCT A,B là: C6H5COOC2H3 và C6H5-CH=CH-COOH
=> ( loại trường hợp axit có CT C6H5-C(COOH)=CH2 vì axit này không bị oxi hóa tạo C6H5COONa và CO2)
PTHH:
C6H5COOC2H3+ 2KMnO4 +3 H2SO4 → C6H5COOH + 2CO2 + K2SO4 + 2MnSO4 + 4H2O
C6H5-CH=CH-COOH +2 KMnO4 + 3H2SO4 →C6H5COOH + 2CO2 + K2SO4 + 2MnSO4 + 4H2O.
Cho KI tác dụng với dung dịch KMnO4 trong môi trường H2SO4, người ta thu được 1,51 gam MnSO4 theo phưong trình phản ứng sau: KI + KMnO4 + H2SO4 g I2 +... Số mol I2 tạo thành và số mol KI phản ứng là:
A. 0,00025 và 0,0005
B. 0,025 và 0,05
C. 0,25 và 0,5
D. 0,0025 và 0,005
Đáp án B
Bước đầu tiên, cần hoàn thành phương trình phản ứng với đầy đủ các chất và hệ số:
![]()
![]()
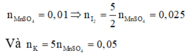
Nhận xét: Ngoài việc viết đầy đủ phản ứng như trên, các bạn vẫn có thể giải quyết bài toán bằng việc áp dụng định luật bảo toàn moi electron và bảo toàn nguyên tố:

Áp dụng định luật bào toàn mol electron, ta có:
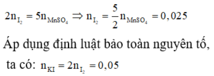
Cho KI tác dụng với dung dịch KMnO4 trong môi trường H2SO4, người ta thu được 1,51 gam MnSO4 theo phưong trình phản ứng sau: KI + KMnO4 + H2SO4 g I2 +... Số mol I2 tạo thành và số mol KI phản ứng là:
A. 0,00025 và 0,0005
B. 0,025 và 0,05
C. 0,25 và 0,5
D. 0,0025 và 0,005
Đáp án B
Bước đầu tiên, cần hoàn thành phương trình phản ứng với đầy đủ các chất và hệ số:
![]()
![]()
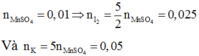
Nhận xét: Ngoài việc viết đầy đủ phản ứng như trên, các bạn vẫn có thể giải quyết bài toán bằng việc áp dụng định luật bảo toàn moi electron và bảo toàn nguyên tố:
Quá trình nhường electron:

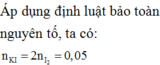
Chia 38,1 gam FeCl2 thành 2 phần, phần 2 có khối lượng gấp 3 lần phần 1. Đem phần 1 phản ứng hết với dung dịch KMnO4 dư, trong môi trường H2SO4 loãng, dư, thu lấy khí thoát ra. Đem toàn bộ khí này phản ứng hết với phần 2, cô cạn dung dịch sau phản ứng thu được m gam chất rắn. Giá trị của m là
A. 29,640.
B. 28,575.
C. 24,375.
D. 33,900.
Đáp án D
n FeCl 2 = 0 , 3 ( mol ) => phần 1: 0,075 mol; phần 2: 0,225 mol
Khi phản ứng với KmnO4 dư; H2SO4 dư, toàn bộ Cl- trong FeCl2 chuyển thành Cl2
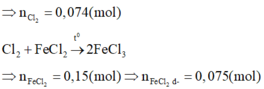
Chú ý:
- Ta có thể nhận thấy toàn bộ lượng Cl2 phản ứng hết với FeCl2 => mmuối thu được = m FeCl 2 + m Cl 2
Nếu KMnO4 và H2SO4 không dư thì có thể vẫn còn Cl-