Điện phân một dung dịch có chứa H 2 S O 4 , C u S O 4 . pH của dung dịch biến đối như thế nào theo thời gian điện phân
A. Tăng dần đến pH = 7 rồi không đổi
B. Giảm dần
C. Tăng dần đến pH > 7 rồi không đổi
D. pH không đổi, luôn nhỏ hơn 7
Cho 13g kẽm (Zn) tác dụng với dung dịch loãng có chứa 49g axit sufuric (H2SO4). Chất nào còn dư sau phản ứng và dư bao nhiêu gam?
( H = 1; Zn = 65; O = 16; S = 32)
nZn = \(\dfrac{13}{65}\) = 0,2mol
nH2SO4 = \(\dfrac{49}{98}\) = 0,5mol
Zn + H2SO4 -> ZnSO4 + H2
0,2(hết);0,5(dư)
nH2SO4 (dư) = 0,5 - 0,2 = 0,3 mol
=>mH2SO4 = 0,3 . 98 = 29,4 g
cho một dung dịch chứa 8g NaOH tác dụng với một dung dịch chứa 3.56g HCl
a. viết phương trình hóa học
b.Dùng quỳ tím thử dung dịch sau phản ứng là 100g.Tính nồng độ % các chất sau phản ứng
c. Cần dùng bao nhiêu gam axit H2SO4 để dung dịch sau phản ứng trên không làm quỳ tím đổi màu?
(Zn=65, H=1, Cl=35.5, Ca=40, Na=23, S=32, O=16)
** Sửa đề thành 3,65 g dung dịch chứa HCl nha bạn **
a)Ta có :
nNaOH = 8 : 40 = 0,2 (mol)
nHCl = 3,65 : 36,5 =0,1 (mol)
(1) NaOH + HCl \(\rightarrow\) NaCl + H2O
T 0,2 0,1
Pư 0,1 0,1 0,1
S 0,1 0 0,1
Vậy dd sau pư có 0,1 mol NaOH dư ; 0,1 mol NaCl
b) Ta có : m dd sau pư = 100 (g)
mNaOH dư = 0,1 . 40 = 4 (g)
mNaCl = 0,1 . 58,5 = 5,85 (g)
C% (NaOH) = 4 : 100 . 100% = 0,04 %
C% (NaCl) = 5,85 : 100 . 100% = 5,85%
c) (2) 2NaOH + H2SO4 \(\rightarrow\) Na2SO4 + H2O
Theo (2) : n\(H_2 SO_4\) = 1/2 nNaOH (dư) = 0,05 (mol)
\(\rightarrow\) m\(H_2 SO_4\) = 0,05 . 98 = 4,9 (g)
Vậy ...
Câu 1: Kể tên một số nguồn điện mà em biết?
Câu 2: Kể tên một số đồ dùng điện sử dụng nguồn điện là pin?
Câu 3: Kể tên một số đồ dùng điện sử dụng nguồn điện là ắc-quy.
Câu 4: Cho một số chất sau: nhôm, đồng, nilon, kẽm, vải khô, chì, dung dịch đồng sunfat.
Câu 5: Trong mạch điện kín, các electron tự do bị cực nào của pin đẩy, cựa nào của pin hút?
Các electron tự do dịch chuyển từ cực nào qua cực nào của pin? Hãy so sánh chiều dòng điện trong mạch và chiều của các electron tự do?
Câu 4 không rõ ý.
Câu 5:
- Trong mạch điện kín, các electron bị cực âm của pin đẩy, cực dương của pin hút.
- Các electron tự do dịch chuyển từ cực dương sang cực âm của pin. Chiều dòng điện trong mạch và chiều của các electron tự do ngược nhau.
b1:Nêu hiện tượng quan sát được và viết phương trình hóa học xảy ra ghi rõ điều kiện phản ứng (Nếu có).
1.cho mẫu kẽm vào ống nghiệm chứa dung dịch HCl (dư)
2.cho mẫu nhôm vào ống nghiệm chứa H2SO4 đặc,nguội
3.Cho dây nhôm vào dung dịch NaOH đặc
4. cho từ từ dung dịch BaCl2 vào ống nghiệm chứa dd H2SO4
5.Cho từ từ dung dịch BaCl2 vào ống nghiệm chứa dd Na2CO3
6.Cho từ từ dung dịch HCl vào ống nghiệm chứa dd NaOH có để sẵn 1 mẫu giấy quỳ tím
7.cho đinh sắt vào ống nghiệm chứa dung dịch CuSO4
8.cho dd NaOH từ từ vào ống nghiệm chứa dung dịch CuSO4.sau đó lọc lấy chất kết tủa rồi Đun nhẹ
9.Cho từ từ dung dịch AgNO3 vào ống nghiệm chứa dung dịch NaCl
10.cho lá đồng vào ống nghiệm chứa dung dịch HCl
1.cho mẫu kẽm vào ống nghiệm chứa dung dịch HCl (dư)
Ht: có khí k màu bay ra,viên kẽm bị tan hoàn toàn taoh thành dd k màu
pthh : Zn+2HCl=>ZnCl2+H2
2.cho mẫu nhôm vào ống nghiệm chứa H2SO4 đặc,nguội
k có hiện tượng xảy ra vì al k tác dụng với H2SO4 đặc,nguội.
3.Cho dây nhôm vào dung dịch NaOH đặc
Ht: có khí không màu thoát ra.dây ngôm bị tan hoàn toàn
pthh Al+NaOH+H2O=>NaAlO2 +3/2H2
4. cho từ từ dung dịch BaCl2 vào ống nghiệm chứa dd H2SO4
Ht: có kết tủa không tan màu trắng xuất hiện
pthh: BaCl2+H2SO4=>BaSO4+H2O
5.Cho từ từ dung dịch BaCl2 vào ống nghiệm chứa dd Na2CO3
ht: xuất hiện chất kết tủa màu trắng
pthh: BaCl2+Na2CO3=>BaCO3+2NaCl
6.Cho từ từ dung dịch HCl vào ống nghiệm chứa dd NaOH có để sẵn 1 mẫu giấy quỳ tím
ht:quỳ tím từ màu xanh sang k màu hoặc nếu HCl dư thì quỳ tím màu đỏ,còn NaOH dư thì quỳ tím màu xanh
pthh: NaOH+HCl=>NaCl+H2O
7.cho đinh sắt vào ống nghiệm chứa dung dịch CuSO4
ht:có chất rắn màu đỏ bám vào đinh sắt
pthh: CuSO4+Fe=> Cu+FeSO4
8.cho dd NaOH từ từ vào ống nghiệm chứa dung dịch CuSO4.sau đó lọc lấy chất kết tủa rồi Đun nhẹ
ht: ban đầu xuất hiện chất kết tủa màu xanh,sau khi đun nhè thì chuyển thành màu đen
pthh: CuSO4+2NaOH=>Cu(OH)2+Na2SO4
Cu(OH)2=>CuO+H2O (Đk;Nhiệt độ)
9.Cho từ từ dung dịch AgNO3 vào ống nghiệm chứa dung dịch NaCl
ht:Xuất hiện kết tủa màu trắng là AgCl
pthh:AgNO3+NaCl=>AgCl+NaNO3
10.cho lá đồng vào ống nghiệm chứa dung dịch HCl
k có ht gì xảy ra
Good luck<3
Có gì k hiểu ib mình
1. Nêu hiện tượng và viết pthh xảy ra, nếu có:
a)Hòa tan Al vào dung dịch Axit HCl
b)Cho từ từ H2SO4vào dung dịch có chứa Cu(OH)2
c)Hòa tan Fe2O3 vào dung dịch Axit HCl
d)Cho Na vào cốc chứa nước
e)Cho Ag vào dung dịch H2SO4 loãng
f)Đốt cháy sắt trong bình chứa oxit
g)Cho Al2O3 vào dung dịch KOH
h)Ngâm Mg vào dung dịch NaCl
i)Nhỏ dung dịch HCl vào ống chứa dung dịch K2CO3
k)Cho dung dịch NaNO3 vào dung dịch H2SO4
L)Cho Fe vào dung dịch CuSO4
M)Cho Mg vào dung dịch AgNO3
a) HT: Al tan dần- có bọt khí k màu xuất hiện
PT: 2Al+ 6HCl ------> 2AlCl3+ 3H2
b) HT: Cu(OH)2(↓) tan dần trong dd tạo ra dd màu xanh lam
( Cu(OH)2 sao tạo ra đc dd bn nhỉ ???=> Đề: Cho Cu(OH)2 khan vào dd H2SO4)
PT: Cu(OH)2+ H2SO4 -----> CuSO4+ 2H2O
c) HT: Fe2O3 tan dần- dd có màu nâu nhạt
PT: Fe2O3+ 6HCl -----> 2FeCl3+ 3H2
d) HT: Na tan dần- có khí k màu xuất hiện
PT: Na+ H2O----->NaOH+ 1/2H2
e) K có hiện tượng
f) HT: Fe cháy sáng trong kk tạo chất rắn màu nâu đen
PT: 3Fe+ 2O2----to->Fe3O4
g) HT: Al2O3 tan trong dd
PT: 2KOH+ Al2O3-----> 2KAlO2+ H2O
h) K có ht
i) HT: Có chất khí k màu xuất hiện
PT: K2CO3+ 2HCl -----> 2KCl+ CO2+ H2O
k) K có ht
L) HT: Fe tan dần trong dd, màu xanh lam của dd nhạt dần, có kim loại màu đỏ xuất hiện
PT: Fe+ CuSO4 ------> FeSO4+ Cu
M) HT: Mg tan trong dd- có kim loại màu trắng xuất hiện
PT: Mg+ 2AgNO3 -----> Mg(NO3)2+ 2Ag
Làm nhanh zùm mk!
Mai kiểm tra rồi
thank all
Điện phân 100ml dung dịch A chứa Cu2+, Na+; H+; SO42- có pH = 1, điện cực trơ. Sau một thời gian điện phân, rút điện cực ra khỏi dung dịch, thấy khối lượng dung dịch giảm 0,64 gam và dung dịch có màu xanh nhạt, thể tích dung dịch không đổi. Tính nồng độ H+ có trong dung dịch sau khi điện phân.
A. 0,2 M
B. 0,1 M.
C. 0,16 M.
D. 0,26 M.
Đáp án D.
Dung dịch sau có màu xanh nhạt nghĩa là vẫn còn ít ion đồng ⟹ H+ chưa bị điện phân.
Gọi số mol Cu2+ điện phân là a (mol) còn số mol O2 tạo ra ở anot là b (mol).
Bảo toàn e suy ra: a = 2b
Khối lượng dung dịch giảm gồm khối lượng Cu và khối lượng khí oxi sinh ra nên:
64a + 32b = 0,64
Từ hai phương trình trên suy ra: b = 0,004 (mol); a =0,008 (mol).
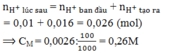
Câu 1 : Để trung hòa 200ml hỗn hợp chứa HCl 0,3M và H2SO4 0,1M cần dùng V(ml) dung dịch Ba(OH)2.Giá trị của V ?
Câu 2 : Cho dung dịch chứa 0,9 mol NaOH vào dung dịch có chứa a mol H3PO4.Sau phản ứng chỉ thu được muối Na3PO4 và H2O.Giá trị của a ?
Câu 3 : cho 200g dung dịch KOH 8,4% hòa tan 14,2g P2O5.Sản phẩm thu được sau phản ứng chứa các chất hòa tan ?
Dung dịch X chứa các ion sau: Al3+, Cu2+, S O 4 2 - và N O 3 - . Để kết tủa hết ion có trong 500 ml dung dịch X cần 100 ml dung dịch BaCl2 1M. Cho 500 ml dung dịch X tác dụng với dung dịch NaOH dư thì được 19,6 gam kết tủa. Cô cạn 500 ml dung dịch X được 66,75 gam hỗn hợp muối khan. Nồng độ mol/l của N O 3 - là:
Nêu hiện tượng quan sát được và viết PTHH xảy ra, ghi rõ điều kiện phản ứng ( nếu có ) :
1, Cho mẫu kẽm vào ống nghiệm chứa dung dịch HCl (dư).
2, Cho mẫu nhôm vào ống nghiệm chứa \(H_2SO_4\) đặc, nguội.
3, Cho dây nhôm vào dung dịch NaOH đặc.
4, Cho từ từ dung dịch \(BaCl_2\) vào ống nghiệm chứa dung dịch \(H_2SO_4\).
5, Cho từ từ dung dịch \(BaCl_2\) vào ống nghiệm chứa dung dịch \(Na_2CO_3\).
6, Cho từ từ dung dịch HCl vào ống nghiệm chứa dung dịch NaOH có để sẵn 1 mẫu giấy quỳ tím.
7, Cho đinh sắt vào ống nghiệm chứa dung dịch \(CuSO_4\).
Chất hữu cơ X mạch hở (chứa C, H, O) có phân tử khối bằng 74(u). Biết X tác dụng được với dung dịch NaOH. Số đồng phân cấu tạo của X thoả mãn là
A. 4
B. 3
C. 5.
D. 2
Chọn A.
+ Đồng phân của axit cacboxylic: C2H5COOH
+ Đồng phân của este: HCOOC2H5, CH3COOCH3.
+ Đồng phân tạp chức: HOOC-CHO