Dung dịch X chứa HCl với nồng độ mol là 0,01M. pH của dung dịch là
A. 1.
B. 2. .
C. 3.
D. 4
Dung dịch X chứa HCl với nồng độ mol là 0,01M. pH của dung dịch là
A. 1
B. 2
C. 3
D. 4
Dung dịch X chứa HCl với nồng độ mol là 0,01M. pH của dung dịch là
A. 1
B. 2
C. 3
D. 4
Đáp án B
HCl là một axit mạnh, điện li hoàn toàn nên ta có:
HCl → H+ + Cl-
0,01M→0,01M
pH = -log[H+] = -log(0,01) = 2
Dung dịch X chứa HCl với nồng độ mol là 0,01M. pH của dung dịch là:
A. 1.
B. 2.
C. 3.
D. 4.
Đáp án B
HCl là một axit mạnh, điện li hoàn toàn nên ta có:
HCl → H+ + Cl-
0,01M→0,01M
pH = -log[H+] = -log(0,01) = 2
Tính số mol, nồng độ mol ion H+ và OH- và pH của dung dịch axit b) HNO3 0,04M c) dung dịch HCl 0.001M d) dung dịch H2SO4 0,003M e) dung dịch HNO3 có pH=2 f) dung dịch H2SO4 có pH=4 g) 200ml dung dịch H2SO4 0,01M + 100ml dung dịch HCl 0,05M Giúp em với ạ
trong 0.5l dung dịch axit có chứa 3.75 gam hcl. Nồng độ mol của dung dịch là A 2 B 5 C3 D 4
\(n_{HCl}=\dfrac{3,75}{36,5}\approx0,1\left(mol\right)\\ \Rightarrow C_{MddHCl}=\dfrac{0,1}{0,5}=0,2M\)
... bài này bn vừa đăng hỏi rồi á :v, trong khoảng thời gian 2 lần đăng đã có người giải cho bn rồi mà :) ?
Hoà tan 6,2g Na2O vào nước được 2 lít dung dịch A. Nồng độ mol/l của dung dịch A là: A 0,05M B:0,01M C: 0,1M D 1M
Số mol của natri oxit
nNa2O = \(\dfrac{m_{Na2O}}{M_{Na2O}}=\dfrac{6,2}{62}=0,1\left(mol\right)\)
Pt : Na2O + H2O→ 2NaOH\(|\)
1 1 2
0,1 0,2
Số mol của dung dịch natri hidroxit
nNaOH = \(\dfrac{0,1.2}{1}=0,2\left(mol\right)\)
Nồng độ mol của dung dịch natri hidroxit
CMNaOH = \(\dfrac{0,2}{2}=0,1\left(M\right)\)
⇒ Chọn câu : C
Chúc bạn học tốt
nNa2O = mNa2O : MNa2O = 6,2 : (23 . 2 + 16) = 0,1 mol
PTHH: Na2O + H2O → 2NaOH
Tỉ lệ 1 2
Phản ứng 0,1 ? mol
Từ PTHH => nNaOH = 2 nNa2O = 0,2 mol
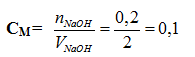
bạn coi thử
Có V1 lít dung dịch A chứa 18,25 gam HCl và V2 lít dung dịch B chứa 10,95 gam HCl. Trộn dung dịch A với dung dịch B ta được dung dịch C có thể tích bằng 2 lít
a) Tính nồng độ mol/lít của dung dịch C
b) tính nồng độ mol/lít của dung dịch A và B, biết CM(A)= CM(B) = 0,8
a,nA=\(\dfrac{18,25}{36,5}\)=0,5(mol)
nB=\(\dfrac{10,95}{36,5}\)=0,3(mol)
→nC=0,3+0,5=0,8(mol)
→CM(C)=\(\dfrac{0,8}{2}\)=0,4M
b,CM(A)=\(\dfrac{0,5}{V1}\)
CM(B)=\(\dfrac{0,3}{V2}\)
→\(\dfrac{0,5}{V1}\)=\(\dfrac{0,3}{V2}\)=0,8
=>V1=0,625 l
=>V2=0,375 l
=>CmV1=\(\dfrac{0,5}{0,625}\)=0,8M
=>CmV2=\(\dfrac{0,3}{0,375}\)=0,8M
Có V1 lít dung dịch A chứa 18,25 gam HCl và V2 lít dung dịch B chứa 10,95 gam HCl. Trộn dung dịch A với dung dịch B ta được dung dịch C có thể tích bằng 2 lít
a) Tính nồng độ mol/lít của dung dịch C
b) tính nồng độ mol/lít của dung dịch A và B, biết CM(A): CM(B) = 0,8
\(a,n_A=\dfrac{18,25}{36,5}=0,5\left(mol\right)\\ n_B=\dfrac{10,95}{36,5}=0,3\left(mol\right)\)
\(\rightarrow n_C=0,3+0,5=0,8\left(mol\right)\\ \rightarrow C_{M\left(C\right)}=\dfrac{0,8}{2}=0,4M\)
\(b,C_{M\left(A\right)}=\dfrac{0,5}{V_1}\\ C_{M\left(B\right)}=\dfrac{0,3}{V_2}\\ \rightarrow\dfrac{0,5}{V_1}:\dfrac{0,3}{V_2}=0,8\\ \rightarrow\dfrac{0,5}{V_1}=\dfrac{0,24}{V_2}=\dfrac{0,5+0,24}{V_1+V_2}=\dfrac{0,74}{2}=0,37\\ \rightarrow\left\{{}\begin{matrix}V_1=\dfrac{0,5}{0,34}=1,4\left(l\right)\\V_2=\dfrac{0,24}{0,34}=0.6\left(l\right)\end{matrix}\right.\\ \rightarrow\left\{{}\begin{matrix}C_{M\left(A\right)}=\dfrac{0,5}{1,4}=0,36M\\C_{M\left(B\right)}=\dfrac{0,5}{0,6}=0,83M\end{matrix}\right.\)
Một dung dịch A có chứa 150 ml dung dịch H2 SO4 0,0 1M . dung dịch B có chứa 250 ml dung dịch NaOH 0,01M.
a) Tính nồng độ mol/ lít của các ion trong dung dịch A và dung dịch B. pH của dung dịch A dung dịch B
b) tính pH của dung dịch sau khi trộn