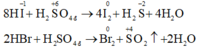Cho 4 đơn chất F 2 ; C l 2 ; B r 2 ; I 2 . Chất có nhiệt độ sôi cao nhất là
A. F 2 .
B. C l 2 .
C. B r 2 .
D. I 2 .
Cho 4 đơn chất F 2 ; C l 2 ; B r 2 ; I 2 . Chất có nhiệt độ sôi cao nhất là
A. F 2 .
B. C l 2 .
C. B r 2 .
D. I 2 .
Chọn đáp án D
Từ F 2 đến I 2 nhiệt độ sôi tăng dần → I 2 có nhiệt độ sôi cao nhất.
I-Trắc nghiệm
Các đơn chất halogen F 2 , C l 2 , B r 2 , I 2 có đặc điểm chung là
A. chất khí ở điều kiện thường.
B. có tính oxi hóa mạnh.
C. vừa có tính oxi hóa, vừa có tính khử.
D. Tác dụng mạnh với nước.
Đặc điểm chung của các đơn chất halogen F 2 , C l 2 , B r 2 , I 2 :
A. ở điều kiện thường là chất khí.
B. tác dụng mãnh liệt với nước.
C. vừa có tính oxi hóa, vừa có tính khử.
D. tính chất hóa học cơ bản là tính oxi hóa.
Chọn đáp án D
A sai vì Ở điều kiện thường: F 2 , C l 2 : trạng thái khí; B r 2 : trạng thái lỏng; I 2 : trạng thái rắn.
B sai vì I 2 hầu như không tác dụng với nước.
C sai vì F 2 chỉ có tính oxi hóa.
Đặc điểm nào dưới đây là đặc điểm chung của các đơn chất Halogen (F2, Cl2, Br2, I2)
A. Ở điều kiện thường là chất khí
B. Vừa có tính oxi hóa, vừa có tính khử
C. Có tính oxi hóa mạnh
D. Tác dụng mạnh với nước
Nguyên tử của các nguyên tố nhóm halogen có 7 e ở lớp ngoài cùng, dễ dàng nhận thêm 1 electron để đạt trạng thái cấu hình khí hiếm bền vững → Có tính oxi hóa mạnh.
Khi cho các halogen tác dụng với nước, chỉ có một chất giải phóng khí O2 đó là:
A. Br2. B. Cl2. C. I2. D. F2.
Khi cho các halogen tác dụng với nước, chỉ có một chất giải phóng khí O2 đó là:
A. Br2. B. Cl2. C. I2. D. F2.
F2+2H2O->2HF+O2
So sánh tc oxi hóa của các đơn chất F2. Cl2. Br2. I2. Dẫn ra pthh minh họa
Cho các phản ứng sau:
(1). Cl2 + 2NaBr → 2NaCl + Br2
(2). Br2 + 2NaI → 2NaBr + I2
(3). Cl2 + 2NaF → 2NaCl + F2
(4). Br2 + 5Cl2 + 6H2O → 2HBrO3 + 10HCl
(5). F2 + 2NaCl → 2NaF + Cl2
(6). HF + AgNO3 → AgF + HNO3
(7). HCl + AgNO3 → AgCl + HNO3
(8). PBr3 + 3H2O → H3PO3 + 3HBr
Số phương trình hóa học viết đúng là :
A. 6
B. 7
C. 5
D. 8
Đáp án C
Các phương trình viết đúng là:
(1). Cl2 + 2NaBr → 2NaCl + Br2
(2). Br2 + 2NaI → 2NaBr + I2
(7). HCl + AgNO3 → AgCl + HNO3
(4). Br2 + 5Cl2 + 6H2O → 2HBrO3 + 10HCl
(8). PBr3 + 3H2O → H3PO3 + 3HBr
Các phản ứng viết sai là:
(3). Cl2 + 2NaF → 2NaCl + F2 vì tính oxi hóa của Cl2 yếu hơn Flo.
(5). F2 + 2NaCl → 2NaF + Cl2 vì Flo có tính oxi hóa rất mạnh nó oxi hóa được H2O.
(6). HF + AgNO3 → AgF + HNO3 vì AgF là chất tan.
Theo dãy: F2 – Cl2 – Br2 – I2 thì
A. tính oxi hóa tăng dần, tính khử giảm dần
B. tính oxi hóa giảm dần, tính khử tăng dần
C. tính oxi hóa giảm dần, tính khử giảm dần
D. tính oxi hóa tăng dần, tính khử tăng
Trong một nhóm, đi từ đầu đến cuối nhóm, tính oxi hóa giảm dần, tính khử tăng dần.
Chất chỉ có tính oxi hoá là
A. F 2 B. Cl 2
C. Br 2 D. cả 3 chất F 2 , Cl 2 , Br 2
So sánh tính chất oxi hóa của các đơn chất F2,Cl2, Br2, I2 và tính khử của những hợp chất HF, HCl, HBr, HI. Dẫn ra những phương trình hóa học để minh họa.
Tính oxi hóa giảm dần từ F2 đến I2.
- Flo là phi kim mạnh nhất, oxi hóa được tất cả các kim loại kể cả vàng và platin. Clo, Br và Iot tác dụng được với một số kim loại.
- Phản ứng với hiđro.

- Halogen đứng trước đẩy halogen đứng sau ra khỏi muối của chúng:
Cl2 + 2NaBr → 2NaCl + Br2
Br2 + 2NaI → 2NaBr + I2
Tính khử của axit tăng theo chiều: HF < HCl < HBr < HI.
- Chỉ có thể oxi hóa F- bằng dòng điện. Còn ion Cl-, Br-, I- đều có thể bị oxi hóa khi tác dụng với chất oxi hóa mạnh.
- HF hoàn toàn không thể hiện tính khử, HCl chỉ thể hiện tính khử khi tác dụng với những chất oxi hóa mạnh, còn HBr và nhất là HI có tính khử mạnh. Axit sunfuric đặc bị HBr khử đến SO2 và bị HI khử đến H2S: