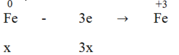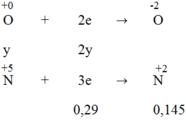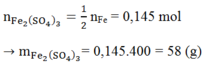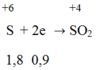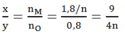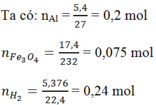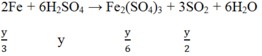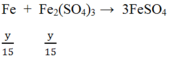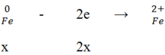Hòa tan hoàn toàn m (g) một oxit sắt bằng H2SO4 đặc nóng thu được a mol SO2 (duy nhất). Mặt khác, sau khi khử hoàn toàn m (g) oxit trên bằng H2 ở nhiệt độ cao rồi cho toàn bộ lượng sắt tạo thành vào H2SO4 đặc nóng dư thì thu được 9a mol SO2 (duy nhất). Vậy oxit sắt là:
A. FeO
B. Fe2O3
C. Fe3O4
D. FeO hoặc Fe2O3