Áp suất hơi bão hòa phụ thuộc vào:
A. nhiệt độ và thể tích của hơi
B. nhiệt độ và bản chất của hơi
C. thể tích và bản chất của hơi
D. nhiệt độ, thể tích và bản chất của hơi
BT5. Ở 46 độ C, áp suất hơi bão hòa của chất A dạng lỏng là 50 mmHg, chất A dạng rắn là 49,5 mmHg. Ở 45 độ C, áp suất hơi bão hòa của A lỏng lớn hơn của A rắn là 1 mmHg. Tính nhiệt nóng chảy, nhiệt thăng hoa và nhiệt độ nóng chảy của chất A. Biết nhiệt hóa hơi của nó là 9 kcal/mol và xem thể tích riêng của A lỏng và A rắn xấp xỉ nhau.
đốt cháy hoàn toàn 2 thể tích hợp chất A cần 9 thể thích khí O2 và tạo ra 6 thể tích khí cacbonic và 8 thể tích hơi nước. Các chấy khí và hơi đo ở cùng điều kiện về nhiệt độ, áp suất. Xác định CTPT của A
Giả sử khí được đo ở điều kiện sao cho 1 mol khí chiếm thể tích 1 lít
\(n_A=\dfrac{2}{1}=2\left(mol\right)\)
\(n_{O_2}=\dfrac{9}{1}=9\left(mol\right)\)
\(n_{CO_2}=\dfrac{6}{1}=6\left(mol\right)\)
\(n_{H_2O}=\dfrac{8}{1}=8\left(mol\right)\)
Bảo toàn C: nC(A) = 6 (mol)
Bảo toàn H: nH(A) = 16 (mol)
Bảo toàn O: \(n_{O\left(A\right)}=6.2+8.1-9.2=2\left(mol\right)\)
Số nguyên tử C là \(\dfrac{6}{2}=3\) (nguyên tử)
Số nguyên tử H là \(\dfrac{16}{2}=8\) (nguyên tử)
Số nguyên tử O là \(\dfrac{2}{2}=1\) (nguyên tử)
=> CTPT: C3H8O
chọn phát biểu sai:
A sự bay hơi là quá trình hóa hơi xảy ra ở bề mặt thoáng của chất lỏng
B sự sôi là quá trình hóa hơi xảy ra cả ở bề mặt thoáng áp suât và trong lòng khối chất lỏng
C sự bay hơi phụ thuộc vào nhiệt độ diện tích mặt thoáng áp suất và bản chất của chất lỏng
D sự sôi phụ thuộc vào nhiệt độ diện tích mặt thoáng áp suất và bàn chất của chất lỏng
BT2. Áp suất hơi bão hòa của axit xyanhydric (HCN) phụ thuộc vào nhiệt độ theo pt: lgP (mmHg) = 7,04 - 1237/T.
Xác định nhiệt độ sôi và nhiệt hóa hơi của nó ở điều kiện thường.
Phân biệt hơi bão hòa với hơi khôi. So sánh áp suất hơi bão hòa với áp suất hơi khô của chất lỏng ở cùng nhiệt độ.
+ Hơi bão hòa là hơi ở trạng thái cân bằng động với chất lỏng của nó: tốc độ bay hơi bằng tốc độ ngưng tụ xảy ra ở bề mặt chất lỏng. Hơi bão hòa có áp suất đạt giá trị cực đại gọi là áp suất hơi bão hòa. Áp suất hơi bão hòa không phụ thuộc thể tích và không tuân theo định luật Bôilơ – Mariốt, nó chỉ phụ thuộc vào bản chất và nhiệt độ của chất lỏng bay hơi.
+ Hơi khô là hơi có tốc độ bay hơi lớn hơn tốc độ ngưng tụ. Hơi khô có áp suất đạt giá trị cực đại. Hơi khô và hơi bão hòa đều gây ra áp suất lên thành bình.
+ Ở cùng nhiệt độ, áp suất hơi khô có giá trị nhỏ hơn, áp suất hơi khô phụ thuộc thể tích và tuân theo định luật Bôilơ – Mariốt.
Tính khối lượng mol phân tử các chất sau: a. Chất A có tỉ khối hơi so với không khí bằng 2,07 b. Thể tích hơi của 3,3gam chất X bằng thể tích của 1,76gam khí oxi (ở cùng điều kiện, nhiệt độ, áp suất)
\(a,M_A=29.2,07\approx 60(g/mol)\\ b,n_X=n_{O_2}=\dfrac{1,76}{32}=0,055(mol)\\ \Rightarrow M_X=\dfrac{3,3}{0,055}=60(g/mol)\)
Phân biệt hơi bão hòa với hơi khô. So sánh áp suất hơi bão hòa với áp suất hơi khô của chất lỏng ở cùng nhiệt độ?
Đốt cháy hết 0,2 ml hơi của hợp chất (X) cần 0,06 ml khí oxi , thu được 0,4 ml CO2 và 0,06 ml hơi nước . Các thể tích khí và hơi đo cùng nhiệt độ áp xuất.Công thức phân tử của hợp chất (X) là.
Để xác định công thức phân tử của hợp chất (X), ta cần phân tích tỷ lệ thể tích các chất tham gia và sản phẩm của phản ứng cháy.
Theo thông tin trong đề bài, để đốt cháy hết 0,2 ml hơi của hợp chất (X), cần 0,06 ml khí oxi. Sản phẩm của phản ứng cháy là 0,4 ml CO2 và 0,06 ml hơi nước.
Ta biết rằng phản ứng cháy của hợp chất (X) có thể được biểu diễn bằng phương trình:
CₓHₓ + yO₂ → zCO₂ + wH₂O
Từ đó, ta có thể lập các phương trình cân bằng thể tích:
0,2 ml hơi (X) → 0,4 ml CO₂ 0,06 ml O₂ → 0,4 ml CO₂
Vì tỷ lệ giữa hơi (X) và O₂ là 1:0,3 (0,2 ml / 0,06 ml), và tỷ lệ giữa CO₂ và O₂ là 0,4:0,06 (0,4 ml / 0,06 ml), nên ta có thể suy ra tỷ lệ giữa hợp chất (X) và CO₂ là 1:0,75 (1:0,3 * 0,4:0,06).
Nếu ta giả sử số mol của hợp chất (X) là a, số mol của CO₂ là b, ta có thể viết lại tỷ lệ trên dưới dạng số mol:
a : 1 b : 0,75
Vì CO₂ có 1 mol cacbon (C) và 2 mol oxi (O₂) trong phân tử, nên số mol cacbon (C) trong hợp chất (X) cũng là b.
Vậy, công thức phân tử của hợp chất (X) là CbHb.
Đốt cháy hoàn toàn 2,20 g chất hữu cơ A, người ta thu được 4,40 g C O 2 và 1,80 g H 2 O .
1. Xác định công thức đơn giản nhất của chất A.
2. Xác định công thức phân tử chất A biết rằng nếu làm bay hơi 1,10 g chất A thì thể tích hơi thu được đúng bằng thể tích của 0,40 g khí O 2 ở cùng nhiệt độ và áp suất.
1. C 2 H 4 O .
2. Số mol A trong 1,10 g A = số mol O 2 trong 0,40 g O 2
n
O
2

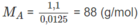
( C 2 H 4 O ) n = 88 ⇒ 44n = 88 ⇒ n = 2
CTPT là C 4 H 8 O 2 .
tính khối lượng mol phân tử các chất sau :
a) chất A có tỉ khối hơi so với không khí là 2,07 .
b) thể tích hơi của 3,3 gam chất X bằng thể tích của 1,76 gam khí oxi ( đo ở cùng điều kiện nhiệt độ , áp suất )
a) Dùng công thức M = 29d = 60 đvC
b) nA = nO2 = 1,76 : 32 = 0,055 mol \(\Rightarrow\) MA = 3,3 : 0,055 = 60 đvC