Hình vẽ sau mô tả thí nghiệm điều chế khí Z:
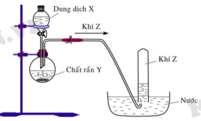
Phương trình hóa học điều chế khí Z là
![]()
![]()
![]()
![]()
Hình vẽ sau mô tả thí nghiệm điều chế khí Z:
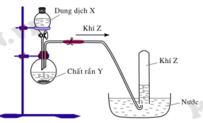
Phương trình hóa học điều chế khí Z là

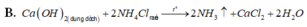
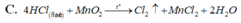
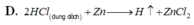
Đáp án D
Khí Z thu bằng cách dời chỗ H2O, nên khí Z không tan trong nước ⇒ Z là H2 (các khí SO2, NH3 và Cl2 tan nhiều trong nước)
Hình vẽ sau mô tả thí nghiệm điều chế khí Z:
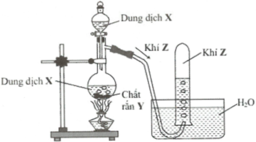
Phương trình hóa học điều chế khí Z là
A. H 2 S O 4 đ ặ c + N a 2 S O 4 r ắ n → S O 2 ↑ + N a 2 S O 4 + H 2 O
B. C a O H 2 d u n g d ị c h + 2 N H 4 C l r ắ n → t 2 N H 3 ↑ + C a C l 2 + 2 H 2 O
C. 4 H C l đ ặ c + M n O 2 → t C l ↑ + M n C l 2 + 2 H 2 O
D. 2 H C l d u n g d ị c h + Z n → Z n C l 2 + H 2
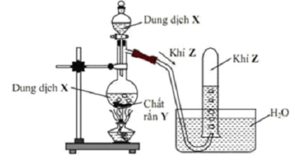
Hình vẽ sau mô tả thí nghiệm điều chế khí Z:
Phương trình hóa học điều chế khí Z là
A. H2SO4 (đặc) + Na2SO3 (rắn) → SO2 + Na2SO4 + H2O
B. Ca(OH)2 + 2NH4Cl 2NH3 + CaCl2 + 2H2O
C. MnO2 + HCl MnCl2 + Cl2↑(lục nhạt) + H2O
D. 2HCl(dung dịch) + Zn → H2↑ + ZnCl2
Hình vẽ sau mô tả thí nghiệm điều chế khí Z:
Phương trình hóa học điều chế khí Z là
A. C a ( O H ) 2 d d + 2 N H 4 C l r → 2 N H 3 + C a C l 2 + 2 H 2 O
B. 2 H C l + Z n → Z n C l 2 + H 2
C. H 2 S O 4 đ ặ c + N a 2 S O 3 → S O 2 + N a 2 S O 4 + H 2 O
D. 4 H C l + M n O 2 → C l 2 + M n C l 2 + 2 H 2 O
Đáp án B
N H 3 , S O 2 , C l 2 tan được trong nước và tác dụng với nước. Do đó ta không thể sử dụng phương pháp đẩy nước để thu các khí này.
Hình vẽ mô tả thí nghiệm điều chế khí Z:
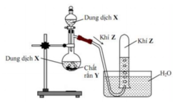
Phương trình hóa học điều chế khí Z là
A. 2HCl (dung dịch) + Zn → H2 ↑ + ZnCl2
B. H2SO4 (đặc) + Na2SO4 (rắn) → SO2 ↑ + Na2SO4 + H2O
C. Ca(OH)2 (dung dịch) + 2NH4Cl(rắn) → 2NH3 ↑ + CaCl2 + 2H2O
D. 4HCl (đặc) + MnO2 → Cl2 ↑ + MnCl2 + 2H2O
Hình vẽ mô tả thí nghiệm điều chế khí Z:
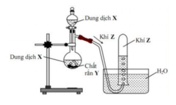
Phương trình hóa học điều chế khí Z là
A. 2HCl (dung dịch) + Zn → H2 + ZnCl2
B. H2SO4 (đặc) + Na2SO4 (rắn) → SO2 + Na2SO4 + H2O
C. Ca(OH)2 (dung dịch) + 2NH4Cl(rắn) → 2NH3 + CaCl2 + 2H2O
D. 4HCl (đặc) + MnO2 → Cl2 + MnCl2 + 2H2O
Khí Z là khí H2 vì khí này nhẹ hơn nước và không tan trong nước
Có thể thu khí H2 bằng phương pháp đẩy nước
Phương trình phản ứng thỏa mãn điều kiện là:
Zn + 2HCl(dung dịch) → ZnCl2 + H2
Đáp án A
Hình vẽ mô tả thí nghiệm điều chế khí Z:

Phương trình hóa học điều chế khi Z là
A. 2HCl(dung dịch) + Zn → H2↑ + ZnCl2.
B. H2SO4(đặc) + Na2SO3 (rắn) → SO2↑ + Na2SO4 + H2O.
C. Ca(OH)2(dung dịch) + 2NH4Cl(rắn) → 2NH3↑ + CaCl2 + 2H2O.
D. 4HCl(đặc) + MnO2 → Cl2↑ + MnCl2 + 2H2O.
Đáp án A
Khi Z là khi H2 vì khí này nhẹ hơn nước và không tan trong nước
→ Có thể thu khí H2 bằng phương pháp đẩy nước
→ Phương trình phản ứng thỏa mãn điều kiện là:
Zn + 2HCl(dung dich) → ZnCl2 + H2↑
Hình vẽ mô tả thí nghiệm điều chế khí Z:

Phương trình hóa học điều chế khi Z là
A. 2HCl(dung dịch) + Zn → H2↑ + ZnCl2.
B. H2SO4(đặc) + Na2SO3 (rắn) → SO2↑ + Na2SO4 + H2O.
C. Ca(OH)2(dung dịch) + 2NH4Cl(rắn) → 2NH3↑ + CaCl2 + 2H2O.
D. 4HCl(đặc) + MnO2 → Cl2↑ + MnCl2 + 2H2O.
Đáp án A
Khi Z là khi H2 vì khí này nhẹ hơn nước và không tan trong nước
→ Có thể thu khí H2 bằng phương pháp đẩy nước
→ Phương trình phản ứng thỏa mãn điều kiện là:
Zn + 2HCl(dung dich) → ZnCl2 + H2↑
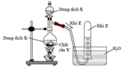
Thí nghiệm điều chế khí Z từ dung dịch X và chất rắn Y được mô tả như hình vẽ sau
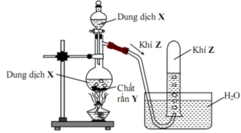
Phương trình hóa học điều chế khí Z là
A. CaC2 + 2H2O Ca(OH)2 + C2H2
B. NaOH + NH4Cl (rắn) NH3 + NaCl + H2O
C. K2SO3 (rắn) + H2SO4 → K2SO4 + SO2 + H2O
D. NaCl (rắn) + H2SO4 (đặc) HCl + NaHSO4