Cho 3,78 gam bột nhôm phản ứng vừa đủ với dung dịch muối XCl3 tạo thành dung dịch Y, khối lượng chất tan trong dung dịch Y giảm 4,06 gam so với dung dịch XCl3. Xác định công thức của muối XCl3:
A. InCl3.
B. GaCl3
C. FeCl3.
D. CrCl3.
Cho 3.78g bột Al phản ứng vừa đủ dung dịch XCl3 tạo ra dung dịch Y, khối lượng chất tan trong dung dịch Y giảm 4.06g so với dung dịch XCl3. Xác định công thức XCl3.
Mn giải bài này giúp mik theo cách tăng giảm khối lượng với, cảm ơn nhiều ạ
\(n_{Al}=\dfrac{3,78}{27}=0,14\left(mol\right)\\ Al+XCl_3\rightarrow AlCl_3+X\\ m_{giảm}=4,06\left(g\right)=m_X-m_{Al}\\n_X=n_{XCl_3}=n_{AlCl_3}=n_{Al}=0,14\left(mol\right)\\ m_X=m_{Al}+4,06=3,78+4,06=7,84\left(g\right)\\ M_X=\dfrac{7,84}{0,14}=56\left(\dfrac{g}{mol}\right)\\ Vậy.XCl_3.là:FeCl_3 \)
Cho 3.78g bột Al phản ứng vừa đủ dung dịch XCl3 tạo ra dung dịch Y, khối lượng chất tan trong dung dịch Y giảm 4.06g so với dung dịch XCl3. Xác định công thức XCl3. tính nồng độ phần trăm các chất tan có trong Y
giải lại: Al + XCl3 => AlCl3 + X
khối lượng chất tan trong ddY giảm 4,04g so vs dd XCl3
=> mXCl3 - mAlCl3 = 4,04 (g)
<=> mX - mAl = 4,04
=> mX = 4,04 + 3,78 =7,82(g)
thep PTHH nXCl3 = nAl = 3,78/ 27 = 0,14 (g)
=> nX = nXCl3 = 0,14
=> M = 7,82 : 0,14 = 56 => FeCl3
Cho 3.78g bột Al phản ứng vừa đủ dung dịch XCl3 tạo ra dung dịch Y, khối lượng chất tan trong dung dịch Y giảm 4.06g so với dung dịch XCl3. Xác định công thức XCl3.
Mọi người giải giúp mình với TT.
P/s có thể giải bài này theo cách tăng giảm khối lượng không nhỉ ?
C1: Al + XCl3 --> AlCl3 + X
nAl = 3,78 : 27 = 0,14 mol. => nAlCl3 tạo ra = 0,14 mol.
=> mAlCl3 = 0,14. 133,5 = 18,69g.
=> mXCl3 = 18,69 + 4,06 = 22,75g.
=> MXCl3 = 22,75 : 0,14 = 162,5 = X + 35,5 .3 => X = 56 (Fe)
C2: Dúng tăng giảm khối lượng
M chênh lệh giữa Al và X là 4,06 : 0,14 = 29 => x = 29 + 27 = 56 (fe)
Cho 3,78 gam bột Nhôm phản ứng vừa đủ với dung dịch muối XCl3 tạo thành dung dịch Y giảm 4,06 gam so với dung dịch XCl3. Tìm công thức của muối XCl3.
Al+XCl3-->AlCl3+X
nAl=0,14mol
-->mXCl3=0,14.(X+106,5) g
mAlCl3=0,14.133,5=18,69g
mà khối lượng chất tan trong dd Y giảm 4.06g so với dung dịch XCl3
nên 0,14.(X+106,5)-18,69=4,06
\(\Rightarrow\)X=56
\(\Rightarrow\)FeCl\(_3\)
nAl = 3.78/27=0.14 mol
Al + XCl3 --> AlCl3 + X
0.14_0.14_____0.14
mAlCl3 = 0.14*133.5 = 18.69 g
TĐ Ta có :
mXCl3 - mAlCl3 = 4.06
0.14(X + 106.5 ) - 18.69 = 4.06
=> X = 56 (Fe)
CT: FeCl3
Cho 5,4 gam kim loại X hóa trị III hòa tan hết vào dung dịch HCl thu được 6,72 lít khí H2 (đktc)
a)Lập PTHH của phản ứng.
b)Xác định kim loại X.
c) Tính khối lượng muối XCl3 tạo thành
\(a,PTHH:2X+6HCl\to 2XCl_3+3H_2\\ b,n_{H_2}=\dfrac{6,72}{22,4}=0,3(mol)\\ \Rightarrow n_{X}=\dfrac{2}{3}n_{H_2}=0,2(mol)\\ \Rightarrow M_{X}=\dfrac{5,4}{0,2}=27(g/mol)\)
Vậy X là nhôm (Al)
\(c,n_{AlCl_3}=n_{Al}=0,2(mol)\\ \Rightarrow m_{AlCl_3}=0,2.133,5=26,7(g)\)
Điện phân dung dịch AgNO3 với điện cực trơ một thời gian, thu được dung dịch X chứa 2 chất tan có cùng nồng độ mol, đồng thời khối lượng dung dịch giảm 9,28 gam so với ban đầu. Cho 2,8 gam bột Fe vào dung dịch X, sau phản ứng thu được NO là sản phẩm khử duy nhất của N+5, dung dịch Y và chất rắn Z. Khối lượng muối tạo thành trong dung dịch Y là
A. 11,48
B. 15,08
C. 10,24
D. 13,64
Điện phân dung dịch AgNO3 với điện cực trơ một thời gian, thu được dung dịch X chứa 2 chất tan có cùng nồng độ mol, đồng thời khối lượng dung dịch giảm 9,28 gam so với ban đầu. Cho 2,8 gam bột Fe vào dung dịch X, sau phản ứng thu được NO là sản phẩm khử duy nhất của N+5, dung dịch Y và chất rắn Z. Khối lượng muối tạo thành trong dung dịch Y là
A. 11,48
B. 15,08
C. 10,24
D. 13,64
Điện phân dung dịch AgNO3 với điện cực trơ một thời gian, thu được dung dịch X chứa 2 chất tan có cùng nồng độ mol, đồng thời khối lượng dung dịch giảm 9,28 gam so với ban đầu. Cho 2,8 gam bột Fe vào dung dịch X, sau phản ứng thu được NO là sản phẩm khử duy nhất của N+5, dung dịch Y và chất rắn Z. Khối lượng muối tạo thành trong dung dịch Y là
A. 11,48
B. 15,08
C. 10,24
D. 13,64
Đáp án A
Hai chất tan trong X là AgNO3 dư và HNO3 mới được tạo sau điện phân.
Theo đó, dung dịch ra Ag2O ứng với giảm 9,28 gam → số mol là 0,04 mol.
Từ lượng ra → đọc ngược lại có 0,08 mol HNO3 (tương quan 2H với 1O).
« Nhận xét:
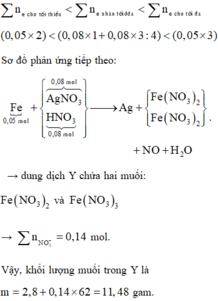
Điện phân dung dịch AgNO3 với điện cực trơ một thời gian, thu được dung dịch X chứa 2 chất tan có cùng nồng độ mol, đồng thời khối lượng dung dịch giảm 9,28 gam so với ban đầu. Cho 2,8 gam bột Fe vào dung dịch X, sau phản ứng thu được NO là sản phẩm khử duy nhất của N+5, dung dịch Y và chất rắn Z. Khối lượng muối tạo thành trong dung dịch Y là
A. 11,48.
B. 15,08.
C. 10,24.
D. 13,64.