Một bình kín chứa khí ôxi ở nhiệt độ 27 ° C và áp suất 10 5 P a . Nếu đem bình phơi nắng ở nhiệt độ 177 o C thì áp suất trong bình sẽ là:
A. 1 , 5.10 5 P a
B. 2 .10 5 P a
C. 2 , 5.10 5 P a
D. 3.10 5 P a
mọingười giúp em câu nàyvới giải chi tiết ra hộ em
Một bình kín chứa khí ôxi ở nhiệt độ 270C và áp suất 105Pa. Nếu đem bình phơi nắng ở nhiệt độ 1770C thì áp suất trong bình sẽ là bao nhiêu?
Ta có
\(\dfrac{p_1}{T_1}=\dfrac{p_2}{T_2}\\ \Rightarrow p_2=\dfrac{10^5.450}{300}=15.10^4Pa\)
Một bình kín chứa khí ôxi ở nhiệt độ 20 ° C và áp suất 10 5 Pa. Nếu đem bình phơi nắng ở nhiệt độ 40 ° C thì áp suất trong bình sẽ là bao nhiêu ?
A. 2. 10 5 Pa. B. 1,068. 10 5 Pa. C. 20. 10 5 Pa. D. 10,68. 10 5 Pa.
Một bình kín chứa 1 mol khí nitơ ở áp suất 10 5 N / m 2 ở 27°C. Nung bình đến khi áp suất khí là 5. 10 5 N/m:. Nhiệt độ khí bây giở là?
A. 127 ° C
B. 60 ° C
C. 135 ° C
D. 1227 ° C
Một bình kín chứa một lượng khí Nito xác định ở áp suất 105 N/m , nhiệt độ 27 độ C . Nung bình đến khi áp suất khí là 5.105 N/m2 . Nhiệt độ khí sau khi nung nóng là
Trạng thái 1: \(\left\{{}\begin{matrix}p_1=10^5Pa\\T_1=27^oC=300K\end{matrix}\right.\)
Trạng thái 2: \(\left\{{}\begin{matrix}p_2=5\cdot10^5Pa\\T_2=???\end{matrix}\right.\)
Quá trình đẳng tích:
\(\dfrac{p_1}{T_1}=\dfrac{p_2}{T_2}\Rightarrow\dfrac{10^5}{300}=\dfrac{5\cdot10^5}{T_2}\)
\(\Rightarrow T_2=1500K=1227^oC\)
Một bình kín chứa 1 mol khí nitơ ở áp suất 10 5 N / m 2 ở 27 ° C
Nung bình đến khi áp suất khí là 5 . 10 5 N / m 2 .Nhiệt độ khí bây giờ là?
A. 127 ° C
B. 60 ° C
C. 135 ° C
D. 1227 ° C
Đáp án D.
Ta có: p 1 T 1 = p 2 T 2 ⇒ T 2 = p 2 p 1 . T 1 = 1500 K = 1227 0 C
Xét một lượng khí không đổi chứa trong một bình kín, ban đầu khí trong bình có nhiệt độ 27 độ C và áp suất 2.10^ 5 Pa, sau đó người ta nung nóng khi đến nhiệt độ 627 độ C . Tìm áp suất của khí trong bình lúc này và vẽ đồ thị biểu diễn quá trình trên trong hệ tọa độ (p, T) ?
Trạng thái 1: \(\left\{{}\begin{matrix}p_1=2\cdot10^5Pa\\T_1=27^oC=300K\end{matrix}\right.\)
Trạng thái 2: \(\left\{{}\begin{matrix}p_2=???\\T_2=627^oC=900K\end{matrix}\right.\)
Quá trình đẳng tích:
\(\dfrac{p_1}{T_1}=\dfrac{p_2}{T_2}\Rightarrow\dfrac{2\cdot10^5}{300}=\dfrac{p_2}{900}\)
\(\Rightarrow p_2=6\cdot10^5Pa\)
3. Một binh kín chứa khí lí tưởng ở áp suất 5 atm và nhiệt độ 37°C. Tính áp suất của khi khi nhiệt độ trong bình là 17"C..
Ta có: \(\dfrac{p_1}{T_1}=\dfrac{p_2}{T_2}\Rightarrow\dfrac{5}{37+273}=\dfrac{p_2}{17+273}\)
\(\Rightarrow p_2=4,68atm\)
Nung nóng khí trong bình kín từ nhiệt độ 27 ° C và áp suất 2 atm. Bỏ qua sự nở vì nhiệt của bình chứa. Khi nhiệt độ khí là 327 ° C , tính áp suất khí trong bình.
- Chỉ ra đây là quá trình đẳng tích
- Áp dụng định luật Sác – lơ:
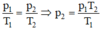
Thay số được p 2 = 4atm.
Một bình kín chứa 1 mol khí Nito, áp suất 10 5 Pa, ở nhiệt độ 27 ° C . Do có một lượng khí thoát ra ngoài nên áp suất của khí trong bình chỉ còn 0,8. 10 5 Pa, nhiệt độ vẫn được giữ không đổi. Lượng khí đã thoát ra ngoài bằng:
A. 0,4mol
B. 0,8mol
C. 0,2mol
D. 0,1mol
Đáp án: C
Ban đầu, khí Nito có khối lượng mm, thể tích V, áp suất p, nhiệt độ T
PT: p 1 V = m M R T 1
- Sau một thời gian, khí Heli có khối lượng m′, thể tích V, áp suất p2, nhiệt độ T
PT: p 2 V = m ' M R T 2
Lấy 2 1 ta được:
p 2 p 1 = m ' m ↔ 0,8 1 = m ' m → m ' = 0,8 m
=> Lượng khí Nito đã thoát ra:
Δ m = m − m ' = m − 0,8 m = 0,2 m = 0,2.1.28 = 5,6 g
Số mol khí Nito thoát ra ngoài là: n = m M = 5,6 28 = 0,2 m o l
Vậy lượng khí đã thoát ra ngoài bằng: 0,2mol