Tính thể tích của N2 và H2 cần dùng để điều chế được 8,4 lit NH3. Các khí đo ở đktc.
Phải dùng bao nhiêu lít khí nitơ và bao nhiêu lít khí hiđro để điều chế 17,00 gram NH3. Biết rằng hiệu suất chuyển hoá thành amoniac là 25%. Các thể tích khí được đo ở đktc.
A. 44,8 lit N2 và 134,4 lit H2
B. 22,4 lit N2 và 134,4 lit H2
C. 22,4 lit N2 và 67,2 lit H2
D. 44,8 lit N2 và 67,2 lit H2
- Đáp án A
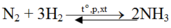
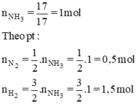
Do hiệu suất 25% nên
nN2cần dùng = 2( mol) và nH2cần dùng = 6(mol).
⇒VN2 = 2. 22,4 = 44,8 (lit) và VH2 = 22,4. 6= 134,4 (lit).
Tính thể tích khí N2 và khí H2 (đktc) cần dùng để điều chế được 17 gam NH3. Biết hiệu suất phản ứng là 25%.
Vì hiệu suất là 25%
=> \(m_{NH_3}=17.\dfrac{25\%}{100\%}=4,25\left(g\right)\)
Ta có: \(n_{NH_3}=\dfrac{4,25}{17}=0,25\left(mol\right)\)
PTHH: N2 + 3H2 ---> 2NH3
Theo PT: \(n_{H_2}=\dfrac{3}{2}.n_{NH_3}=\dfrac{3}{2}.0,25=0,375\left(mol\right)\)
=> \(V_{H_2}=0,375.22,4=8,4\left(lít\right)\)
Theo PT: \(n_{N_2}=\dfrac{1}{2}.n_{NH_3}=\dfrac{1}{2}.0,25=0,125\left(mol\right)\)
=> \(V_{N_2}=0,125.22,4=2,8\left(lít\right)\)
\(n_{NH_3}=1\left(mol\right)\)
Bảo toàn nguyên tố:
\(\left\{{}\begin{matrix}n_{N_2}=\dfrac{n_{NH_3}}{2}=0,5\left(mol\right)\\n_{H_2}=\dfrac{3n_{NH_3}}{2}=1,5\left(mol\right)\end{matrix}\right.\)
Do hiệu suất 25% \(\Rightarrow\left\{{}\begin{matrix}n_{N_2}=2\left(mol\right)\\n_{H_2}=6\left(mol\right)\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}V_{N_2}=44,8\left(l\right)\\n_{H_2}=134,4\left(l\right)\end{matrix}\right.\)
Cần lấy bao nhiêu lít N2 và H2 để điều chế được 4,48 lít NH3, biết hiệu suất phản ứng là 20%. Các khí được đo ở đktc
PTHH:3H2+N2=2NH3
nNH3=0,2(mol) suy ra nH2=0,3(mol);nN2=0,1(mol)
suy ra V H2=6,72(l);V N2=2,24(l)
mà hiệu suất phản ứng chỉ có 20 phần trăm
suy ra V H2 cần dùng để điều chế 4,48 lít NH3 là:6,72x100:20=3,36(l)
V N2 cần dùng để điều chế 4,48 lít NH3 là:2,24x100:20=11,2(l)
Phải dùng bao nhiêu lít khí nitơ và bao nhiêu lít khí hidro để điều chế 17 gam NH3, biết rằng hiệu suất chuyển hóa thành amoniac là 25%. Các thể tích khí đo được ở đktc.
A. 44,8 lít N2 và 13,44 lít H2.
B. 22,4 lít N2 và 134,4 lít H2.
C. 22,4 lít N2 và 67,2 lít H2.
D. 44,8 lít N2 và 67,2 lít H2.
$n_{NH_3} = \dfrac{17}{17} = 1(mol)$
$N_2 + 3H_2 \xrightarrow{t^o} 2NH_3$
Theo PTHH :
$n_{N_2\ pư} = \dfrac{1}{2}n_{NH_3} = 0,5(mol)$
$n_{H_2\ pư} = \dfrac{3}{2}n_{NH_3} = 1,5(mol)$
Suy ra :
$n_{N_2\ đã\ dùng} = \dfrac{0,5}{25\%} = 2(mol)$
$n_{H_2\ đã\ dùng} = \dfrac{1,5}{25\%} = 6(mol)$
Vậy :
$V_{N_2} = 2.22,4 = 44,8(lít)$
$V_{H_2} = 6.22,4 = 134,4(lít)$
Để điều chế 2 lít NH3 từ N2 và H2 với hiệu suất 25% thì thể tích N2 cần dùng ở cùng điều kiện là:
A. 8 lít
B. 2 lít
C. 4 lít
D. 1 lít
Để điều chế 4 lít NH 3 từ N 2 và H 2 với hiệu suất 25% thì thể tích N 2 cần dùng ở cùng điều kiện là:
A. 8 lít.
B. 16 lít.
C. 2 lít.
D. 4 lít.
Để điều chế 4 lít NH3 từ N2 và H2 với hiệu suất 50% thì thể tích H2 cần dùng ở điều kiện là bao nhiêu?
A. 4 lít
B. 6 lít
C. 8 lít
D. 12 lít
Đáp án D
N2 + 3H2![]() 2NH3
2NH3
Theo PT VH2=3/2VNH3= 6 lít
Do hiệu suất 50% nên:
VH2 thực tế= 100. VH2/50= 100.6/50= 12 lít
bài 5: trong công nghiệp người ta điều chế nh3; bằng phản ứng sau
n₂ + 3h₂\(⇌\) 2nh3
a) tính khối nh3 thu được nếu cho 224 lit khí n2 (đktc) tác dụng với một lượng dư h2. biết hiệu suất phản ứng là 45%.
b) tính khối lượng h, và khối lượng nợ cần để điều chế được 17 kg nh3, biết hiệu suất phản ứng là 40%.
c) cho 448 lit nz tác dụng với 448 lit hz sẽ thu được bao nhiêu kg nh3, biết hiệu suất phản úng là 39%, thể tích các khí đo ở đktc.
d) cho 112 lit khí n2 (đktc) tác dụng với lượng dư h2 thì thu được 168 lit khí nh3 (đktc). tính hiệu suất phản ứng. (cho m: n = 14, h =1 )
Đốt cháy hoàn toàn một hỗn hợp khí gồm có CO và H2 cần dùng 6,72 lit khí O2. Khí sinh ra có 4,48 lit khí CO2. Hãy tính thành phần % của hỗn hợp khí ban đầu theo thể tích hỗn hợp( các thể tích khí đều đo ở cùng đktc)
\(n_{O_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\\ n_{CO_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH:
2CO + O2 --to--> 2CO2
0,2<---0,1<--------0,2
2H2 + O2 --to--> 2H2O
0,4<--0,2<-------0,2
\(\Rightarrow\left\{{}\begin{matrix}\%V_{CO}=\dfrac{0,2}{0,2+0,4}.100\%=33,33\%\\\%V_{H_2}=100\%-33,33\%=66,67\%\end{matrix}\right.\)
\(n_{CO_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\\ n_{O_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH: 2CO + O2 --to--> 2CO2
0,3<--0,15<------0,3
2H2 + O2 --to--> 2H2O
0,1<--0,05
\(\Rightarrow\left\{{}\begin{matrix}\%V_{CO}=\%n_{CO}=\dfrac{0,3}{0,3+0,1}.100\%=75\%\\\%V_{H_2}=100\%-75\%=25\%\end{matrix}\right.\)