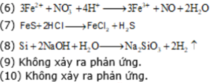Có các dung dịch KOH, HCl, H 2 SO 4 (loãng) ; các chất rắn Fe OH 3 , Cu và các chất khí CO 2 , NO.
Những chất nào có thể tác dụng với nhau từng đôi một ? Viết các phương trình hoá học.
(Biết H 2 SO 4 loãng không tác dụng với Cu).
1. Tính pH của 100ml dung dịch X có hòa tan 2,24 lít khí HCl (đktc)
2. Tính nồng độ mol/l của các dung dịch:
a) Dung dịch H2SO4 có pH = 4.
b) Dung dịch KOH có pH = 11.
3. Pha loãng 200ml dung dịch Ba(OH)2 với 1,3 lít nước thu được dung dịch có pH = 12. Tính nồng độ mol/l của dung dịch Ba(OH)2 ban đầu, biết rằng Ba(OH)2 phân ly hoàn toàn.
4. Pha loãng 10ml HCl với nước thành 250ml. Dung dịch thu được có pH = 3. Hãy tính nồng độ mol/l của HCl trước khi pha loãng và pH của dung dịch đó.
5. Trộn 100ml dung dịch HCl 0,25M với 300ml dung dịch HNO3 0,05M. pH của dung dịch thu được là:
6. Trộn lẫn 3 dung dịch NaOH 0,02M; KOH 0,03M và Ba(OH)2 0,01M theo tỉ lệ thể tích tương ứng là 1:1:2 thu được dung dịch có pH là bao nhiêu?
7. Phải thêm bao nhiêu ml dung dịch HCl pH = 2 vào 90 ml nước để được dung dịch có pH = 3?
Phải thêm bao nhiêu ml nước vào 10 ml dung dịch NaOH 0,1M để thu dung dịch có pH = 12?
2. Tính nồng độ mol/l của các dung dịch:
a) Dung dịch H2SO4 có pH = 4.
\(pH=4\Rightarrow\left[H^+\right]=10^{-4}M\)
=> \(CM_{H_2SO_4}=\dfrac{\left[H^+\right]}{2}=\dfrac{10^{-4}}{2}=5.10^{-5M}\)
b) Dung dịch KOH có pH = 11.
\(pH=11\Rightarrow pOH=14-11=3\)
=> \(\left[OH^-\right]=10^{-3}=CM_{KOH}\)
3. Pha loãng 200ml dung dịch Ba(OH)2 với 1,3 lít nước thu được dung dịch có pH = 12. Tính nồng độ mol/l của dung dịch Ba(OH)2 ban đầu, biết rằng Ba(OH)2 phân ly hoàn toàn.
Đặt CM Ba(OH)2 = xM
=> \(n_{Ba\left(OH\right)_2}=0,2x\left(mol\right)\)
\(V_{sau}=V_{Ba\left(OH\right)_2}+V_{H_2O}=0,2+1,3=1,5\left(l\right)\)
pH=12 => pOH=2 => \(\left[OH^-\right]=10^{-2}M\)
\(Ba\left(OH\right)_2\rightarrow Ba^{2+}+2OH^-\)
0,2x----------------------------->0,4x
=> \(\left[OH^-\right]=\dfrac{0,4x}{1,5}=10^{-2}\)
=> x=0,0375M
Vậy nồng độ mol/l của dung dịch Ba(OH)2 ban đầu là 0,0375M
1. Tính pH của 100ml dung dịch X có hòa tan 2,24 lít khí HCl (đktc)
\(n_{HCl}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
=> \(n_{H^+}=0,1\left(mol\right)\)
=> \(\left[H^+\right]=\dfrac{0,1}{0,1}=1M\Rightarrow pH=0\)
Xem lại đề câu này nha bạn
Sục Cl2 vào dung dịch KOH loãng thu được dung dịch A, hòa tan I2 vào dung dịch KOH loãng thu được dung dịch B (tiến hành ở nhiệt độ phòng).
1) Viết phương trình hóa học xảy ra.
2) Viết phương trình hóa học xảy ra khi cho lần lượt các dung dịch: hỗn hợp HCl và FeCl2, Br2, H2O2, CO2 vào dung dịch A (không có Cl2 dư, chỉ chứa các muối).
a) Ở nhiệt độ thường:
2KOH + Cl2 \(\rightarrow\) KCl + KClO + H2O
6KOH + 3I2 \(\rightarrow\) 5KI + KIO3 + 3H2O
(Trong môi trường kiềm tồn tại cân bằng : \(\text{3XO- ⇌X- + XO}_3^-\)
Ion ClO- phân hủy rất chậm ở nhiệt độ thường và phân hủy nhanh khi đun nóng, ion IO- phân hủy ở tất cả các nhiệt độ).
b) Các phương trình hóa học :
Ion ClO- có tính oxi hóa rất mạnh, thể hiện trong các phương trình hóa học:
- Khi cho dung dịch FeCl2 và HCl vào dung dịch A có khí vàng lục thoát ra và dung dịch từ không màu chuyển sang màu vàng nâu :
2FeCl2 + 2KClO + 4HCl \(\rightarrow\) 2FeCl3 + Cl2 + 2KCl + 2H2O
- Khi cho dung dịch Br2 vào dung dịch A, dung dịch brom mất màu :
Br2 + 5KClO + H2O \(\rightarrow\) 2HBrO3 + 5KCl
- Khi cho H2O2 vào dung dịch A, có khí không màu, không mùi thoát ra:
H2O2 + KClO \(\rightarrow\) H2O + O2 + KCl
- khi cho CO2 vào A
CO2 + KClO + H2O \(\rightarrow\) KHCO3 + HClO
Thực hiện các thí nghiệm sau:
(a) Cho dung dịch HCl vào dung dịch Fe(NO3) 2.
(b) Cho FeS vào dung dịch HCl.
(c) Cho Cr2O3 vào dung dịch NaOH loãng.
(d) Cho dung dịch AgNO3 vào dung dịch FeCl3.
(e) Cho Fe vào bình chứa HCl đặc, nguội.
(f) Sục khí SO2 vào dung dịch KMnO4.
(g) Al2O3 vào dung dịch KOH.
(h) KMnO4 vào dung dịch hỗn hợp FeSO4 và H2SO4.
Trong các thí nghiệm trên, số thí nghiệm có xảy ra phản ứng là
A.6.
B.5
C.7
D.4
Thực hiện các thí nghiệm sau:
(a) Cho dung dịch HCl vào dung dịch Fe(NO3)2. (b) Cho FeS vào dung dịch HCl.
(c) Cho Cr2O3 vào dung dịch NaOH loãng. (d) Cho dung dịch AgNO3 vào dung dịch FeCl3.
(e) Cho Fe vào bình chứa HCl đặc, nguội. (f) Sục khí SO2 vào dung dịch KMnO4.
(g) Al2O3 vào dung dịch KOH.
(h) KMnO4 vào dung dịch hỗn hợp FeSO4 và H2SO4.
Trong các thí nghiệm trên, số thí nghiệm có xảy ra phản ứng là
A. 6.
B. 5.
C. 7.
D. 4.
Đáp án C
(a), (b), (d), (e), (f), (g), (h)
Thực hiện các thí nghiệm sau:
(a) Cho dung dịch HCl vào dung dịch Fe(NO3)2.
(b) Cho FeS vào dung dịch HCl.
(c) Cho Cr2O3 vào dung dịch NaOH loãng.
(d) Cho dung dịch AgNO3 vào dung dịch FeCl3.
(e) Cho Fe vào bình chứa HCl đặc, nguội.
(f) Sục khí SO2 vào dung dịch KMnO4.
(g) Al2O3 vào dung dịch KOH.
(h) KMnO4 vào dung dịch hỗn hợp FeSO4 và H2SO4.
Trong các thí nghiệm trên, số thí nghiệm có xảy ra phản ứng là
A. 6
B. 5
C. 7
D. 4
Thực hiện các thí nghiệm sau:
(a) Cho dung dịch HCl vào dung dịch Fe(NO3)2. (b) Cho FeS vào dung dịch HCl.
(c) Cho Cr2O3 vào dung dịch NaOH loãng. (d) Cho dung dịch AgNO3 vào dung dịch FeCl3.
(e) Cho Fe vào bình chứa HCl đặc, nguội. (f) Sục khí SO2 vào dung dịch KMnO4.
(g) Al2O3 vào dung dịch KOH.
(h) KMnO4 vào dung dịch hỗn hợp FeSO4 và H2SO4.
Trong các thí nghiệm trên, số thí nghiệm có xảy ra phản ứng là
A. 6.
B. 5.
C. 7.
D. 4.
Đáp án C
(a), (b), (d), (e), (f), (g), (h)
Thực hiện các thí nghiệm sau:
(a) Cho dung dịch HCl vào dung dịch Fe(NO3) 2.
(b) Cho FeS vào dung dịch HCl.
(c) Cho Cr2O3 vào dung dịch NaOH loãng.
(d) Cho dung dịch AgNO3 vào dung dịch FeCl3.
(e) Cho Fe vào bình chứa HCl đặc, nguội.
(f) Sục khí SO2 vào dung dịch KMnO4.
(g) Al2O3 vào dung dịch KOH.
(h) KMnO4 vào dung dịch hỗn hợp FeSO4 và H2SO4.
Trong các thí nghiệm trên, số thí nghiệm có xảy ra phản ứng là
A. 6
B. 5
C. 7
D. 4
Các thí nghiệm xảy ra phản ứng là a, b, d, e, f, g, h.
Cr2O3 chỉ tan trong NaOH đặc nóng, có điều kiện áp suất cao.
![]()
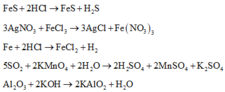
![]()
![]()
=> Chọn đáp án C.
Thực hiện các thí nghiệm sau
(a) Cho dung dịch HCl vào dung dịch Fe(NO3)2. (b) Cho FeS vào dung dịch HCl.
(c) Cho Cr2O3 vào dung dịch NaOH loãng. (d) Cho dung dịch AgNO3 vào dung dịch FeCl3.
(e) Cho Fe vào bình chứa HCl đặc, nguội. (f) Sục khí SO2 vào dung dịch KmnO4
(g) Al2O3 vào dung dịch KOH. (h) KmnO4 vào dung dịch hỗn hợp FeSO4 và H2SO4.
Trong các thí nghiệm trên, số thí nghiệm xảy ra phản ứng là
A. 6
B. 5
C. 7
D. 4
Đáp án C
Các thí nghiệm xảy ra phản ứng: a, b, d, e, f, g, h
Chú ý:
Cr2O3 chỉ tan trong kiềm đặc chứ không tan trong kiềm loãng
Tiến hành các thí nghiệm sau:
(1) Sục khí etilen vào dung dịch KMnO4 loãng.
(2) Cho hơi ancol etylic đi qua bột CuO nung nóng.
(3) Sục khí etilen vào dung dịch Br2 trong CCl4.
(4) Cho dung dịch glucozơ vào dung dịch AgNO3 trong NH3 dư, đun nóng.
(5) Cho Fe3O4 vào dung dịch H2SO4 đặc, nóng.
(6) Cho dung dịch HCl vào dung dịch Fe(NO3)2.
(7) Cho FeS vào dung dịch HCl.
(8) Cho Si vào dung dịch NaOH đặc, nóng.
(9) Cho Cr vào dung dịch KOH loãng.
(10) Nung NaCl ở nhiệt độ cao.
Trong các thí nghiệm trên, số thí nghiệm có xảy ra phản ứng oxi hóa-khử là:
A. 8
B. Đáp án khác
C. 7
D. 9
Tiến hành các thí nghiệm sau:
(1) Sục khí etilen vào dung dịch KMnO4 loãng.
(2) Cho hơi ancol etylic đi qua bột CuO nung nóng.
(3) Sục khí etilen vào dung dịch Br2 trong CCl4.
(4) Cho dung dịch glucozơ vào dung dịch AgNO3 trong NH3 dư, đun nóng.
(5) Cho Fe3O4 vào dung dịch H2SO4 đặc, nóng.
(6) Cho dung dịch HCl vào dung dịch Fe(NO3)2.
(7) Cho FeS vào dung dịch HCl.
(8) Cho Si vào dung dịch NaOH đặc, nóng.
(9) Cho Cr vào dung dịch KOH loãng
(10) Nung NaCl ở nhiệt độ cao.
Trong các thí nghiệm trên, số thí nghiệm có xảy ra phản ứng oxi hóa-khử là:
A. 8.
B. Đáp án khác.
C. 7.
D. 9.
Đáp án C
Định hướng tư duy giải
Các phản ứng oxi hóa khử là: 1; 2; 3; 4; 5; 6; 8.
![]()
![]()
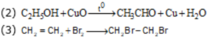
![]()
![]()
![]()
![]()