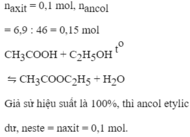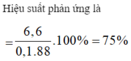Tính thể tích khí C O 2 thoát ra (đktc) khi đem 100ml dung dịch C H 3 C O O H 1M tác dụng với M g C O 3 dư.

Những câu hỏi liên quan
Đem 100ml dung dịch C H 3 C O O H 1M tác dụng với 6,9 g C H 3 C H 2 O H thu được 6,6 g C H 3 C O O C 2 H 5 . Tính hiệu suất phản ứng. (Cho H=1, C=12, O=16)
Có 6,5g Zn tác dụng với dung dịch H2SO4 loãng a) Viết phương trình phản ứng b) thể tích của chất khí thoát ra ở đktc c) tính khối lượng của muối tạo thành phản ứng sau ( Cho biết H=1, Zn =65,S=39,O=16) Mình đang cần gấp
a) \(n_{Zn}=\dfrac{6,5}{65}=0,1\left(mol\right)\)
PTHH:
Zn + H2SO4(l) ---> ZnSO4 + H2
0,1------------------>0,1------>0,1
b) VH2 = 0,1.24,79 = 2,479 (l)
c) mZnSO4 = 0,1.136 = 13,6 (g)
Đúng 1
Bình luận (0)
Cho 6,5 gam kẽm tác dụng hết với V lít dung dịch axit clohidric 1M a, Tính thể tích khí thoát ra ở đktc b, Tính thể tích dung dịch axit clohidric 1M đã dùng c, Nếu dùng dung dịch axit sunfuric 24,5% thay thế cho dung dịch axit clohidric 1M thì tốn hết bao nhiêu gam dung dịch axit sunfuric 24,5% để hòa tan hết lượng kẽm ở trên?
Mọi người giải giúp mình với ạ mai mình kiểm tra rồi :((
Cho 7,2 g kim loại Mg tác dụng với dung dịch HCl tạo thành muối MgCl2 và giải phóng khí H2
a) Viết phương trình phản ứng xảy ra
b) Tính thể tích khí thoát ra o đktc
a) PTHH: Mg + 2HCl ===> MgCl2 + H2\(\uparrow\)
b) nMg = 7,2 / 24 = 0,3 mol
=> nH2 = nMg = 0,3 mol
=> VH2(đktc) = 0,3 x 22,4 = 6,72 lít
Đúng 0
Bình luận (0)
a) PTHH: Mg+ 2HCl -> MgCl2 + H2
b) Thể tích khí thoát ra (đktc):
Ta có: nMg= \(\frac{7,2}{24}=0,3\left(mol\right)\)
=> \(n_{H_2}\)= nMg= 0,3 (mol)
=> \(V_{H_2\left(đktc\right)}\)= \(n_{H_2}.22,4=0,3.22,4=6,72\left(l\right)\)
Đúng 0
Bình luận (0)
Hợp chất hữu cơ X mạch hở chứa C, H, O. Lấy 0,1 mol X cho tác dụng vừa đủ với 200 ml dung dịch NaOH 1M chỉ thu được 19,6 gam chất hữu cơ Y và 6,2 gam ancol Z. Đem Y tác dụng với dung dịch HCl loãng, dư thu được hợp chất hữu cơ E. Khi E tác dụng với Na thì số mol khí H2 thoát ra bằng số mol E tham gia phản ứng. Kết luận không đúng về X là A. Trong X có 2 nhóm hiđroxyl B. X có 2 chức este C. X có công thức phân tử C6H10O6 D. X có khả năng tham gia phản ứng tráng bạc
Đọc tiếp
Hợp chất hữu cơ X mạch hở chứa C, H, O. Lấy 0,1 mol X cho tác dụng vừa đủ với 200 ml dung dịch NaOH 1M chỉ thu được 19,6 gam chất hữu cơ Y và 6,2 gam ancol Z. Đem Y tác dụng với dung dịch HCl loãng, dư thu được hợp chất hữu cơ E. Khi E tác dụng với Na thì số mol khí H2 thoát ra bằng số mol E tham gia phản ứng. Kết luận không đúng về X là
A. Trong X có 2 nhóm hiđroxyl
B. X có 2 chức este
C. X có công thức phân tử C6H10O6
D. X có khả năng tham gia phản ứng tráng bạc
Đáp án D
Ta có: n N a O H = 0,2mol
Y tác dụng với Na thu được số mol khí H2 bằng số mol E nên E có 2 H linh động, hơn nữa X tác dụng với NaOH theo tỉ lệ 1:2 nên X sẽ phải có 2 nhóm COO.
Bảo toàn khối lượng: m x = 6,2 + 19,6 - 0,2.40 = 17,8
→ M x = 178
Ta có: n z = 0 , 2 n với n là số nhóm - O H → M z = 31 n
thỏa mãn n = 2 thì Z là HOCH2CH2OH.
Vì X mạch hở nên Y là muối axit đơn chức → M Y = 98 thỏa mãn Y là HOCH2COONa (vì E phải có liên kết hidro).
Suy ra X là HOCH2COOCH2CH2OOCCH2OH nên nhận định sai là X có khả năng tráng bạc
Đúng 0
Bình luận (0)
Hợp chất hữu cơ X mạch hở chứa C, H, O. Lấy 0,1 mol X cho tác dụng vừa đủ với 200 ml dung dịch NaOH 1M chỉ thu được 19,6 gam chất hữu cơ Y và 6,2 gam ancol Z. Đem Y tác dụng với dung dịch HCl loãng, dư thu được hợp chất hữu cơ E. Khi E tác dụng với Na thì số mol khí H2 thoát ra bằng số mol E tham gia phản ứng. Kết luận không đúng về X là A. Trong X có 2 nhóm hiđroxyl B. X có 2 chức este C. X có công thức phân tử C6H10O6 D. X có khả năng tham gia phản ứng tráng bạc
Đọc tiếp
Hợp chất hữu cơ X mạch hở chứa C, H, O. Lấy 0,1 mol X cho tác dụng vừa đủ với 200 ml dung dịch NaOH 1M chỉ thu được 19,6 gam chất hữu cơ Y và 6,2 gam ancol Z. Đem Y tác dụng với dung dịch HCl loãng, dư thu được hợp chất hữu cơ E. Khi E tác dụng với Na thì số mol khí H2 thoát ra bằng số mol E tham gia phản ứng. Kết luận không đúng về X là
A. Trong X có 2 nhóm hiđroxyl
B. X có 2 chức este
C. X có công thức phân tử C6H10O6
D. X có khả năng tham gia phản ứng tráng bạc
Đáp án D
Ta có: ![]() .
.
Y tác dụng với Na thu được số mol khí H2 bằng số mol E nên E có 2 H linh động, hơn nữa X tác dụng với NaOH theo tỉ lệ 1:2 nên X sẽ phải có 2 nhóm COO.
Bảo toàn khối lượng: ![]()
Ta có:
n
z
=
0
,
2
n
với n là số nhóm ![]() thỏa mãn n = 2 thì Z là HOCH2CH2OH.
thỏa mãn n = 2 thì Z là HOCH2CH2OH.
Vì X mạch hở nên Y là muối axit đơn chức → M y = 98 thỏa mãn Y là HOCH2COONa (vì E phải có liên kết hidro).
Suy ra X là
HOCH2COOCH2CH2OOCCH2OH nên nhận định sai là X có khả năng tráng bạc
Đúng 0
Bình luận (0)
1/ Hòa tan m (g) Na2O vào nước thu được dung dịch A. Trung hòa A cần 200ml dung dịch dồm HCl 0,5M và H2SO4 0,25M. Tính giá trị của m ?2/ Trộn 100ml dung dịch H2SO4 1,1M với 100ml dung dịch NaOH 1M thu được dung dịch A. Cho vào dung dịch A 1,35g Al thì thu được thể tích H2 ở đktc là bao nhiêu ?3/ Dung dịch X có thể tích 300ml chứ Ca(OH)2 0,3M có thể hấp thụ tối đa bao nhiêu lít CO2 ở đktc ?4/ Cho 2,3 g một kim loại hóa trị I tác dụng với nước sinh ra 1,12 lít khí H2 ở đktc. Xác định kim loại đó.
Đọc tiếp
1/ Hòa tan m (g) Na2O vào nước thu được dung dịch A. Trung hòa A cần 200ml dung dịch dồm HCl 0,5M và H2SO4 0,25M. Tính giá trị của m ?
2/ Trộn 100ml dung dịch H2SO4 1,1M với 100ml dung dịch NaOH 1M thu được dung dịch A. Cho vào dung dịch A 1,35g Al thì thu được thể tích H2 ở đktc là bao nhiêu ?
3/ Dung dịch X có thể tích 300ml chứ Ca(OH)2 0,3M có thể hấp thụ tối đa bao nhiêu lít CO2 ở đktc ?
4/ Cho 2,3 g một kim loại hóa trị I tác dụng với nước sinh ra 1,12 lít khí H2 ở đktc. Xác định kim loại đó.
. Cho 10,8 gam Al tác dụng với dung dịch axit sunfuric loãng 1M thu được muối nhôm sunfat và giải phóng khí hidro. a.Viết phương trình hóa học của phản ứng. b.Tính thể tích khí hiđro thoát ra ở (đktc) c. Tính thể tích dung dịch axit sunfuric đã phản ứng d. Dẫn khí sinh ra trong phản ứng trên qua ống sứ chứa 16g Fe2O3 nung nóng. Tính khối lượng kim loại thu được sau phản ứng.
a) 2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
b) \(n_{Al}=\dfrac{10,8}{27}=0,4\left(mol\right)\)
PTHH: 2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
0,4--->0,6-------------------->0,6
=> VH2 = 0,6.22,4 = 13,44 (l)
c) \(V_{dd.H_2SO_4}=\dfrac{0,6}{1}=0,6\left(l\right)\)
d) \(n_{Fe_2O_3}=\dfrac{16}{160}=0,1\left(mol\right)\)
PTHH: Fe2O3 + 3H2 --to--> 2Fe + 3H2O
Xét tỉ lệ: \(\dfrac{0,1}{1}< \dfrac{0,6}{3}\) => Fe2O3 hết, H2 dư
PTHH: Fe2O3 + 3H2 --to--> 2Fe + 3H2O
0,1----------------->0,2
=> mFe = 0,2.56 = 11,2 (g)
Đúng 2
Bình luận (0)
Cho 4,8g Mg tác dụng vừa đủ với 100g dung dịch HCl. Hãy tính: a Thể tích H2 thoát ra ở đktc b Nồng độ % của dung dịch axit HCl đã dùng ( Cho biết O = 16;H = 1;Mg = 24;Cl = 35,5)
a, Ta có: \(n_{Mg}=\dfrac{4,8}{24}=0,2\left(mol\right)\)
PT: \(Mg+2HCl\rightarrow MgCl_2+H_2\)
Theo PT: \(n_{H_2}=n_{Mg}=0,2\left(mol\right)\Rightarrow V_{H_2}=0,2.22,4=4,48\left(l\right)\)
b, \(n_{HCl}=2n_{Mg}=0,4\left(mol\right)\Rightarrow C\%_{HCl}=\dfrac{0,4.36,5}{100}.100\%=14,6\%\)
Đúng 2
Bình luận (0)
Để giải bài toán này, ta cần viết phương trình phản ứng giữa Mg và HCl:
$$\text{Mg} + 2\text{HCl} \rightarrow \text{MgCl}2 + \text{H}2$$
Theo đó, 1 mol Mg tác dụng với 2 mol HCl để tạo ra 1 mol H2. Ta có thể tính số mol Mg trong 4,8g Mg như sau:
$$n{\text{Mg}} = \frac{m{\text{Mg}}}{M_{\text{Mg}}} = \frac{4,8}{24} = 0,2 \text{mol}$$
Vì 1 mol Mg tác dụng với 2 mol HCl để tạo ra 1 mol H2, nên số mol HCl cần để tác dụng với 0,2 mol Mg là 0,4 mol. Từ đó, ta có thể tính khối lượng HCl cần dùng như sau:
$$m_{\text{HCl}} = n_{\text{HCl}} \times M_{\text{HCl}} = 0,4 \times 36,5 = 14,6 \text{g}$$
Vậy, dung dịch HCl có nồng độ $c = \frac{m_{\text{HCl}}}{V_{\text{HCl}}}$, trong đó $V_{\text{HCl}}$ là thể tích dung dịch HCl đã dùng. Để tính thể tích HCl đã dùng, ta cần biết nồng độ của dung dịch axit HCl đã dùng. Ta có thể tính nồng độ % của dung dịch axit HCl như sau:
$$\text{nồng độ %} = \frac{m_{\text{HCl}}}{m_{\text{dung dịch}}} \times 100%$$
Trong đó, $m_{\text{dung dịch}}$ là khối lượng của dung dịch HCl đã dùng. Từ đó, ta có thể tính được thể tích dung dịch HCl đã dùng và thể tích H2 thoát ra ở đktc như sau:
\begin{align*}
m_{\text{dung dịch}} &= \frac{m_{\text{HCl}}}{\text{nồng độ %}} = \frac{14,6}{36,5} \times 100% = 40\text{g} \
V_{\text{HCl}} &= \frac{m_{\text{HCl}}}{c_{\text{HCl}}} = \frac{14,6}{0,365} = 40\text{mL} \
V_{\text{H}2} &= n{\text{H}2} \times V{\text{m}} = 0,1 \times 24,45 = 2,445\text{L}
\end{align*}
Vậy, thể tích H2 thoát ra ở đktc là 2,445 L.
Đúng 1
Bình luận (1)