Kim loại nào cho nhiều thể tích khí H 2 hơn khi cho cùng một khối lượng hai kim loại Zn và Fe tác dụng hết với axit H 2 S O 4 ?
A. không xác định được
B. Zn
C. bằng nhau
D. Fe
Cho kim loại : Zn,Alo,Fe,Mg lần lượt tác dụng với dung dịch H2SO4 loãng. Nếu cho cùng một khối lượng kim loại trên tác dụng hết với axit ,thì kim loại nào cho nhiều khí h2 nhất
Bài 1:
a, PT: \(Zn+2HCl\rightarrow ZnCl_2+H_2\) (1)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\) (2)
b, Giả sử: mZn = mAl = a (g)
\(\Rightarrow\left\{{}\begin{matrix}n_{Zn}=\dfrac{a}{65}\left(mol\right)\\n_{Al}=\dfrac{a}{27}\left(mol\right)\end{matrix}\right.\)
Theo PT: \(\left\{{}\begin{matrix}n_{H_2\left(1\right)}=n_{Zn}=\dfrac{a}{65}\left(mol\right)\\n_{H_2\left(2\right)}=n_{Al}=\dfrac{a}{27}\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow n_{H_2\left(1\right)}< n_{H_2\left(2\right)}\)
Vậy: Al cho nhiều khí H2 hơn.
c, Giả sử: nH2 (1) = nH2 (2) = b (mol)
Theo PT: \(\left\{{}\begin{matrix}n_{Zn}=n_{H_2\left(1\right)}=b\left(mol\right)\\n_{Al}=n_{H_2\left(2\right)}=b\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Zn}=65b\left(g\right)\\m_{Al}=27b\left(g\right)\end{matrix}\right.\)
\(\Rightarrow m_{Zn}>m_{Al}\)
Vậy: Khối lượng Al đã pư nhỏ hơn.
Bài 2:
PT: \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
a, Ta có: \(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
\(n_{H_2SO_4}=\dfrac{9,8}{98}=0,1\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,2}{1}>\dfrac{0,1}{1}\), ta được Fe dư.
Theo PT: \(n_{Fe\left(pư\right)}=n_{H_2SO_4}=0,1\left(mol\right)\)
\(\Rightarrow n_{Fe\left(dư\right)}=0,1\left(mol\right)\Rightarrow m_{Fe\left(dư\right)}=0,1.56=5,6\left(g\right)\)
b, Theo PT: \(n_{H_2}=n_{H_2SO_4}=0,1\left(mol\right)\)
\(\Rightarrow V_{H_2}=0,1.22,4=2,24\left(l\right)\)
Bạn tham khảo nhé!
Cho các kim loại kẽm, nhôm, sắt lần lượt tác dụng với dung dịch axit sunfuric loãng.
a) Viết các phương trình phản ứng.
b) Cho cùng một khối lượng các kim loại trên tác dụng hết với axit sunfuric? Kim loại nào cho nhiều khi hiđro nhất?
c) Nếu thu được cùng một thể tích khí hiđro thì khối lượng kim loại nào nhỏ nhất?
a) Phương trình phản ứng:
Zn + H2SO4 → ZnSO4 + H2
Fe + H2SO4loãng → FeSO4 + H2
2Al+ 3H2SO4 → Al2(SO4)3 + 3H2
b) Giả sử cho cùng một khối lượng là a g kim loại kẽm sắt và nhôm
Zn + H2SO4 → ZnSO4 + H2 (1)
Fe + H2SO4loãng → FeSO4 + H2 (2)
2Al+ 3H2SO4 → Al2(SO4)3 + 3H2 (3)
Ta có 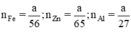
Theo pt nH2 (1) = nZn = 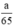 mol
mol
nH2 (2) = nFe = 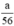 mol
mol
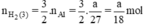
Như vậy ta nhận thấy 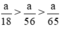 ⇒ nH2 (3) > nH2 (2) > nH2 (1)
⇒ nH2 (3) > nH2 (2) > nH2 (1)
Như vậy cho cùng một lượng kim loại tác dụng với axit H2SO4 loãng dư thì nhôm cho nhiều khí hidro hơn, sau đó đến sắt và ít nhất là kẽm
c) Nếu thu được cùng một lượng khí hidro thì khối lượng kim loại ít nhất là nhôm, sau đó đến sắt, cuối cùng là kẽm.
Bài 7 : Cho 43,7 gam hỗn hợp 2 kim loại Zn và Fe tác dụng với dung dịch axit clohiđric sinh ra 15,68 lít khí H₂(đktc). a) Tính khối lượng mỗi kim loại trong hỗn hợp trên . b) Tính khối lượng sắt sinh ra khi cho toàn bộ khí H₂ thu được ở trên tác dụng hoàn toàn với 46,4 gam Fe₃O₄
Cho cùng một lượng các kim loại Al, Zn, Mg lần lượt tác dụng hết với dung dịch H 2 SO 4 loãng, sau phản ứng thu được muối sunfat (tạo bởi kim loại kết hợp với nhóm SO 4 ) và khí H 2 . Vậy thể tích khí H 2 thoát ra từ kim loại nào lớn nhất?
có ai giúp mik ik
Gọi mMg = mZn = mFe = a(g)
\(n_{Mg}=\dfrac{a}{24}\left(mol\right),n_{Al}=\dfrac{a}{27}\left(mol\right)\\ n_{Zn}=\dfrac{a}{65}\left(mol\right),n_{Fe}=\dfrac{a}{56}\left(mol\right)\\ Mg+H_2SO_4\rightarrow MgSO_4+H_2\)
\(\dfrac{a}{24}\) --> \(\dfrac{a}{24}\left(mol\right)\) (1)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
\(\dfrac{a}{27}\) --> \(\dfrac{a}{16}\left(mol\right)\) (2)
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
\(\dfrac{a}{65}\) --> \(\dfrac{a}{65}\left(mol\right)\) (3)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
\(\dfrac{a}{56}\) --> \(\dfrac{a}{56}\left(mol\right)\) (4)
Từ (1),(2),(3),(4) có: \(\dfrac{a}{16}>\dfrac{a}{24}>\dfrac{a}{56}>\dfrac{a}{65}\)
Vậy \(V_{H_2}\) thoát ra từ kim loại \(Al\) là lớn nhất
Cho các kim loại kẽm, nhôm, sắt lần lượt tác dụng với dung dịch axit sunfuric loãng.
a) Viết các phương trình phản ứng
b) Cho cùng một khối lượng các kim loại trên tác dụng hết với axit thì kim loại nào cho nhiều khí hiđro nhất ?
c) Nếu thu được cùng một thể tích khí Hiđro thì khối lượng của kim loại nào đã phản ứng là nhỏ nhất ?
a)
\(Zn+H2SO4\rightarrow ZnSO4+H2\)
\(2Al+3H2SO4\rightarrow Al2\left(SO4\right)3+3H2\)
\(Fe+H2SO4\rightarrow FeSO4+H2\)
b) giải sử khối KL cùng là \(m\left(g\right)\)
\(\Rightarrow n_{Zn}=\frac{m}{65}\Rightarrow n_{H_2}=\frac{m}{65}\)
\(\Rightarrow n_{Al}=\frac{m}{27}\Rightarrow n_{H_2}=1,5.\frac{m}{27}\)
\(\Rightarrow n_{Fe}=\frac{m}{56}\Rightarrow n_{H_2}=\frac{m}{56}\)
\(\Rightarrow Al\)
c) Giả sử : \(n_{H_2}=0,15mol\)
\(\Rightarrow n_{Zn}=0,15mol\Rightarrow m=9,75g\)
\(\Rightarrow n_{Al}=0,1mol\Rightarrow m=2,7g\)
\(\Rightarrow n_{Fe}=0,15mol\Rightarrow m=8,4g\)
\(\Rightarrow Al\)
:Cho các kim loại Zn , Fe , Al lần lượt tác dụng vớidd H2SO4 loãng.Nếu cùng 1mol các kim loại trên tác dụng hết với axit ,thì kim loại nào cho nhiều hidro nhất
A/ Zn ; B/ Fe ; C/ Al D/Không kim loại nào
\(pthh:Fe+H_2SO_4\rightarrow FeSO_4+H_2\Rightarrow n_{H_2}=n_{Fe}=1\left(mol\right)\\ 2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\Rightarrow n_{H_2}=\dfrac{3}{2}n_{Al}=1,5\left(mol\right)\\ Zn+H_2SO_4\rightarrow ZnSO_4+H_2\Rightarrow n_{H_2}=n_{Zn}=1\left(mol\right)\)
→Al cho nhiều Hidro hơn
Lấy cùng một khối lượng ban đầu các kim loại Mg,Al,Zn,Fe cho tác dụng với dung dịch H2SO4 loãng dư. Kim loại nào giải phóng lượng khí H2 nhiều nhất ở cùng điều kiện ?
A. Mg
B. Zn
C. Fe
D. Al
Đáp án : D
Khi phản ứng với H+
1 mol Al -> 1,5 mol H2
1 mol (Zn,Mg,Fe) -> 1 mol H2
Nếu lấy cùng một khối lượng kim loại Na, Al, Fe rồi cho tác dụng lần lượt với dung dịch HCl dư thì kim loại nào cho nhiều thể tích khí H2 (đktc) nhất
2Na + 2HCl => 2NaCl + H2
x/23________________x/46
2Al + 6HCl => 2AlCl3 + 3H2
x/27_________________x/18
Fe + 2HCl => FeCl2 + H2
x/56_______________x/56
x/18 > x/46 > x/56
=> Al cho nhiều H2 nhất
Gọi KL là x. (g) (x>0)
PTHH: Na + HCl -> NaCl + 1/2 H2
x/23___________________x/46(mol)
PTHH: 2 Al + 6 HCl -> 2 AlCl3 + 3 H2
x/27_______________________x/18(mol)
PTHH: Fe + 2 HCl -> FeCl2 + H2
x/56_____________________x/56(mol)
Vì số mol tỉ lệ thuận thể tích : x/18 > x/46> x/56
=>Kim loại Al cho thể tích H2 lớn nhất.