Cho H2 dư qua 8,14 gam hỗn hợp A gồm CuO, A l 2 O 3 và F e x O y nung nóng. Sau khi phản ứng xong, thu được 1,44 gam H 2 O và a gam chất rắn. Giá trị của a là
A. 6,70
B. 6,86
C. 6,78
D. 6,80
Cho H2 dư qua 8,14 gam hỗn hợp A gồm CuO, Al 2 O 3 và Fe x O y nung nóng. Sau khi phản ứng xong, thu được 1,44 gam H 2 O và a gam chất rắn. Giá trị của a là :
A. 6,70
B. 6,86
C. 6,78
D. 6,80
Hỗn hợp A có khối lượng 8,14 gam gồm: CuO, Al 2 O 3 và một oxit sắt. Cho H 2 dư qua A nung nóng, sau khi phản ứng xong thu được 1,44 gam H 2 O . Hòa tan hoàn toàn A cần 170 ml dung dịch H 2 SO 4 1M loãng được dung dịch B. Cho B tác dụng với NH 3 dư lọc lấy kết tủa đem nung trong không khí thu được 6,66 gam chất rắn. Công thức phân tử của oxit sắt và khối lượng của nó trong A là
A. Fe3O4; 3,48 gam.
B. Fe3O4; 2,32 gam.
C. FeO; 1,44 gam.
D. Fe2O3; 1,60 gam.
Hỗn hợp A có khối lượng 8,14 gam gồm: CuO, Al2O3 và một oxit sắt. Cho H2 dư qua A nung nóng, sau khi phản ứng xong thu được 1,44 gam H2O. Hòa tan hoàn toàn A cần 170 ml dung dịch H2SO4 1M loãng được dung dịch B. Cho B tác dụng với NH3 dư lọc lấy kết tủa đem nung trong không khí thu được 6,66 gam chất rắn. Công thức phân tử của oxit sắt và khối lượng của nó trong A là
A. Fe3O4; 3,48 gam.
B. Fe3O4; 2,32 gam.
C. FeO; 1,44 gam.
D. Fe2O3; 1,60 gam.
Chọn đáp án A
Quy A về Cu, Al, Fe và O || [O] + H2SO4 → SO42– + H2O ⇒ nO = nH2SO4 = 0,17 mol.
H2 + [O] → H2O (trừ Al2O3) ⇒ nAl2O3 = (0,17 - 0,08)/3 = 0,03 mol ⇒ nAl = 0,06 mol.
||► Rắn gồm 0,03 mol Al2O3 và Fe2O3 ⇒ nFe2O3 = (6,66 - 0,03 × 102)/160 = 0,0225 mol
⇒ nFe = 0,045 mol ⇒ nCu = (8,14 - 0,06 × 27 - 0,045 × 56 - 0,17 × 16)/64 = 0,02 mol.
⇒ nO/oxit sắt = 0,17 - 0,09 - 0,02 = 0,06 mo ⇒ Fe : O = 0,045 : 0,06 = 3 : 4 ⇒ Fe3O4
⇒ moxit sắt = 0,015 × 232 = 3,48(g) ⇒ chọn A.
Cho $8,14$ gam hỗn hợp A gồm $CuO$, $Al_{2}O_{3}$, $Fe_{x}O_{y}$. Cho $H_{2}$ dư đi qua A nung nóng thu được $1,44$ gam $H_{2}O$. Hòa tan hoàn toàn A cần vừa đủ $170$ml dung dịch $H_{2}SO_{4}$ $1M$ được dung dịch B. Cho B+ $NaOH_{dư}$ thu được kết tủa. Nung kết tủa trong không khí đến khối lượng không đổi thì thu được $5,2$ gam chất rắn. Tìm công thức của oxit sắt.
Cho hỗn hợp A gồm: Fe, CuO, Fe3O4.
- Cho khí CO dư đi qua a gam A nung nóng. Sau phản ứng hoàn toàn thu được 2,92 gam chất rắn và 3,136 lít (đktc) hỗn hợp khí X ( gồm CO và CO2 ) có dx/H2 = 16.
- Mặt khác hòa tan hoàn toàn a gam hỗn hợp A cần dùng 100 gam hỗn hợp H2SO4 5,39%. Sau phản ứng kết thúc thu được dung dịch B ( gồm 3 muối sunfat và V lít khí H2 (đktc)).
1. Xác định giá trị a và V.
2. Tính C% mỗi chất trong dung dịch B.
3. Cho lượng dư dung dịch Ba(OH)2 tác dụng với dung dịch B trong môi trường không khí. Khi các phản ứng hóa học xảy ra hoàn toàn, lọc lấy kết tủa làm khô, ẩm được b gam chất rắn khan. Xác định giá trị b.
giúp mình vs:((
1) \(\left\{{}\begin{matrix}n_{CO}+n_{CO_2}=\dfrac{3,136}{22,4}=0,14\left(mol\right)\\\dfrac{28.n_{CO}+44.n_{CO_2}}{n_{CO}+n_{CO_2}}=16.2=32\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}n_{CO}=0,105\left(mol\right)\\n_{CO_2}=0,035\left(mol\right)\end{matrix}\right.\)
nO = nCO2 = 0,035 (mol)
=> a = 2,92 + 0,035.16 = 3,48(g)
\(n_{H_2SO_4}=\dfrac{100.5,39\%}{98}=0,055\left(mol\right)\)
nH2O = nO = 0,035 (mol)
Bảo toàn H: \(n_{H_2}=\dfrac{0,055.2-0,035.2}{2}=0,02\left(mol\right)\)
=> \(V=0,02.22,4=0,448\left(l\right)\)
2) Gọi \(\left\{{}\begin{matrix}n_{Fe}=a\left(mol\right)\\n_{Fe_3O_4}=b\left(mol\right)\\n_{CuO}=c\left(mol\right)\end{matrix}\right.\)
=> 56a + 232b + 80c = 3,48 (1)
Bảo toàn Fe: nFe = a + 3b (mol)
Bảo toàn Cu: nCu = c (mol)
PTHH: Fe + H2SO4 --> FeSO4 + H2
0,02<-0,02<------0,02<---0,02
Fe3O4 + 4H2SO4 --> Fe2(SO4)3 + FeSO4 + 4H2O
b--->4b------------>b-------------->b
CuO + H2SO4 --> CuSO4 + H2O
c---->c------------>c
=> a = 0,02
=> 0,02 + 4b + c = 0,055 => 4b + c = 0,035
(1) => 232b + 80c = 2,36
=> b = 0,005 (mol); c = 0,015 (mol)
B chứa \(\left\{{}\begin{matrix}FeSO_4:0,025\left(mol\right)\\Fe_2\left(SO_4\right)_3:0,005\left(mol\right)\\CuSO_4:0,015\left(mol\right)\end{matrix}\right.\)
mdd sau pư = 3,48 + 100 - 0,02.2 = 103,44 (g)
=> \(\left\{{}\begin{matrix}C\%_{FeSO_4}=\dfrac{0,025.152}{103,44}.100\%=3,674\%\\C\%_{Fe_2\left(SO_4\right)_3}=\dfrac{0,005.400}{103,44}.100\%=1,933\%\\C\%_{CuSO_4}=\dfrac{0,015.160}{103,44}.100\%=2,32\%\end{matrix}\right.\)
3)
Rắn khan chứa \(\left\{{}\begin{matrix}BaSO_4\\Fe\left(OH\right)_3\\Cu\left(OH\right)_2\end{matrix}\right.\)
Có: \(n_{BaSO_4}=n_{SO_4}=0,055\left(mol\right)\)
Bảo toàn Fe: \(n_{Fe\left(OH\right)_3}=n_{FeSO_4}+2.n_{Fe_2\left(SO_4\right)_3}=0,035\left(mol\right)\)
Bảo toàn Cu: \(n_{Cu\left(OH\right)_2}=0,015\left(mol\right)\)
=> b = 0,055.233 + 0,035.107 + 0,015.98 = 18,03 (g)
Câu 3: Hòa tan hoàn toàn 36,8 gam hỗn hợp X gồm Fe, Fe3O4 và CuO trong dd HCl dư thu được dd A và 2,24 lít khí H2 (đktc). Dẫn khí H2S dư vào dd A thu được 12,8 gam kết tủa. Nếu cho hỗn hợp X trên tác dụng với axit H2SO4 đặc, nóng, dư thì tạo ra V lít khí SO2 (sản phẩm khử duy nhất và đo ở đktc). Các p/ư xảy ra hoàn toàn. Viết các phương trình hóa học của các p/ư xảy ra và xác định chất khử, chất oxi hóa trong các p/ư đó. Tính giá trị của V
Hỗn hợp X gồm A l 2 O 3 , M g O , F e 2 O 3 , CuO. Cho khí H2 dư qua X nung nóng được chất rắn Y. Cho Y vào dung dịch dư được dung dịch E và chất rắn G. Cho chất rắn G vào dung dịch NaOH dư thu được chất rắn F. Chất rắn F gồm
A. C u , A l 2 O 3 , M g O , F e 3 O 4
B. C u
C. C u , M g O
D. C u , M g O , F e 3 O 4
Dẫn a mol hỗn hợp X (gồm hơi nước và khí CO 2 ) qua cacbon nung đỏ, thu được 1,8a mol hỗn hợp khí Y gồm H 2 , CO và CO 2 . Cho Y đi qua ống đựng hỗn hợp gồm CuO và Fe 2 O 3 (dư, nung nóng), sau khi các phản ứng xảy ra hoàn toàn, khối lượng chất rắn giảm 1,28 gam. Giá trị của a là
A. 0,10.
B. 0,04.
C. 0,05.
D. 0,08.
Chọn C
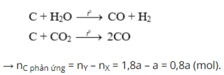
Theo bài ra có khối lượng chất rắn giảm chính bằng khối lượng O bị lấy ra khỏi oxit.
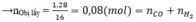
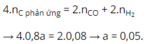
Bảo toàn electron:
dẫn H2 dư qua 8,14 gam hỗn hợp A gồm CuO,Al2O3, oxit sắt nung nóng, sau phản ứng hoàn toàn thu được 1,44 gam H2O. Mặt khác hòa tan hoàn toàn 8,14 gam A cần 170ml dung dịch H2SO4 loãng 1M thu được dung dịch B. Cho B tác dụng với dung dịch NaOH loãng dư lọc kết tủa đem nung trong không khí đến khối lượng không đổi thu được 5,2 gam chất rắn.
Xác định công thức của oxit sắt và tính khối lượng từng chất trong A
CuO (1)
Al2O3 (2)
FexOy (3)
BTNT: nO trong (1)(3) = nO(H2O) = nH2O = 0,08 mol
nO(A) = nH2SO4 = 0,17 mol
\(\rightarrow\) \(\text{nO(2) = 0,17 - 0,08 = 0,09 mol}\)
\(\rightarrow\) \(\text{nAl2O3 = 0,09 : 3 = 0,03 mol}\)
Gọi a và b lần lượt là số mol của Cu và Fe trong A
\(\rightarrow\) \(\text{64a + 56b = mA - mAl2O3 - mOtrong (1) (3) = 3,8 g}\)
mchấtrắn = 80a + \(\frac{160}{2}\) b = 5,2 g
\(\rightarrow\) a = 0,045 , b = 0,02
\(\rightarrow\) nCuO = nCu = b = 0,02 mol
\(\rightarrow\) nO trong (3) = 0,08 - 0,02 = 0,06 mol
\(\rightarrow\) x : y = nFe : nO(3) = 0,045 : 0,06 = 3: 4
\(\rightarrow\) Công thức oxit sắt là Fe3O4
mFe3O4 = 3,48 g
mCuO = 1,6g
mAl2O3 = 3,06 g