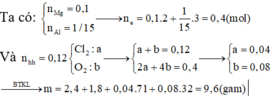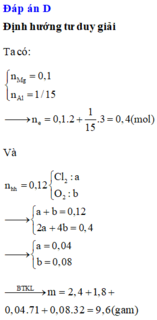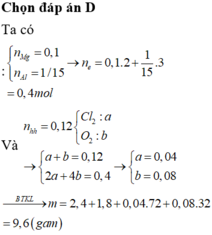Đốt cháy hoàn toàn 3,7 gam hỗn hợp khí Z gồm metan và butan C 4 H 10 . Sau khi kết thúc phản ứng, thu được 11 gam khí C O 2 . Tính thành phần phần trăm theo khối lượng mỗi khí trong hỗn hợp ban đầu.

Những câu hỏi liên quan
Đốt cháy hoàn toàn 3.7g hỗn hợp khí X gồm metan (CH4) và butan (C4H10). Sau khi kết thúc phản ứng thu được 11g khí CO2. Tính thành phần phần trăm theo khối lượng mỗi khí trong hỗn hợp ban đầu.
PTHH: CH4 + 2O2 → CO2 ↑ + 2H2O
2C4H10 + 13O2 → 8CO2 ↑ + 10H2O
( Gọi a là số mol của CH4 và 2b là số mol của C4H10 => Số mol của CO2 ở pt (1) là: a và số mol CO2 ở pt (2) là: 8b )
Theo đề bài ra ta có hệ phương trình sau:
16a + 58. 2b = 3,7
44a + 44. 8b = 11
=> a = 0,05 ; b = 0,025
Khối lượng của khí metan trong hỗn hợp ban đầu là:
16 . 0,05 = 0,8 (gam)
Khối lượng của khí butan trong hỗn hợp ban đầu là:
58 . 2. 0,025 = 2,9 (gam)
Đúng 1
Bình luận (5)
Sau khi kết thúc phản ứng cracking butan thu 22,4 lit hỗn hợp khí X (giả sử chỉ gồm các hiđrocacbon). Cho X lội từ từ qua dung dịch brom dư thì chỉ còn 13,44 lit hỗn hợp khí Y. Đốt cháy hoàn toàn 0,6 lit hỗn hợp khí Y thu được 1,3 lit CO2. Các thể tích khí đều đo ở đktc. Thể tích khí O2 cần để đốt cháy hoàn toàn Y là A. 50,4 lit B. 45,6 lít C. 71,68 lít D. 67,2 lít
Đọc tiếp
Sau khi kết thúc phản ứng cracking butan thu 22,4 lit hỗn hợp khí X (giả sử chỉ gồm các hiđrocacbon). Cho X lội từ từ qua dung dịch brom dư thì chỉ còn 13,44 lit hỗn hợp khí Y. Đốt cháy hoàn toàn 0,6 lit hỗn hợp khí Y thu được 1,3 lit CO2. Các thể tích khí đều đo ở đktc. Thể tích khí O2 cần để đốt cháy hoàn toàn Y là
A. 50,4 lit
B. 45,6 lít
C. 71,68 lít
D. 67,2 lít
Đáp án A
Crackinh butan → 1 mol hhX.
X đi qua brom dư thì còn 13,44 lít hhY. Đốt cháy 0,6 lít hhY → 1,3 lít CO2.
• Đốt cháy 0,6 lít hhY gồm các ankan thu được 1,3 lít CO2
→ Đốt cháy 13,44 lít hhY thì thu được:
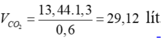
Vì hhY gồm ankan
→ VH2O = VCO2 + Vankan = 13,44 + 29,12 = 42,56 lít.
Theo BTNT O: VO2 = (2 x VCO2 + VH2O) : 2
= (29,12 x 2 + 42,56) : 2 = 50,4 lít
Đúng 0
Bình luận (0)
Đốt cháy hoàn toàn 1,84 gam hỗn hợp gồm metan, axetilen và butan bằng khí O2. Hấp thụ toàn bộ sản phẩm cháy vào bình đựng dung dịch Ca(OH)2 dư, tạo thành m gam kết tủa, đồng thời khối lượng phần dung dịch giảm 4,76 gam so với ban đầu. Giá trị của m là
Thuần đốt cháy :
⇒ nhìn hỗn hợp hiđrocacbon gồm a mol C + b mol H2.
Đốt cháy 1,84 gam hỗn hợp + O2 a mol CO2 + b mol H2O.
Ta có :
Ca(OH)2 dùng dư :
Δmdung dịch giảm = mCaCO3↓ – ∑(mCO2 + mH2O)
→Ta có: 100a – (44a + 18b) = 4,76
=>56a – 18b = 4,76. (1)
Lại có :
12a + 2b = mhỗn hợp = 1,84 (2)
Từ 1, 2=> a = 0,13; b = 0,14.
→ m gam kết tủa là 0,13 mol CaCO3 → m = 13,0 gam.
Đúng 2
Bình luận (1)
Tính thể tích khí O2(đktc) cần dùng để đốt cháy hoàn toàn 7,4 gam hỗn hợp khí metan và khí butan(C4H10). Biết rằng sau phản ứng người ta thu được 22 gam khí CO2
16nmetan+58nbutan=7,4 (1).
BT C: nmetan+4nbutan=22/44=0,5 (2).
Giải hệ phương trình gồm (1) và (2), ta suy ra nmetan=0,1 (mol) và nbutan=0,1 (mol).
Số mol nước tạo ra là 0,5.(0,1.4+0,1.10)=0,7 (mol).
BTKL: 7,4+32nkhí oxi=22+0,7.18, suy ra nkhí oxi=0,85 (mol).
Thể tích khí oxi cần tìm là 0,85.22,4=19,04 (lít).
Đúng 1
Bình luận (2)
\(n_{CO_2}=\dfrac{22}{44}=0,5mol\)
Gọi \(\left\{{}\begin{matrix}n_{CH_4}=x\\n_{C_4H_{10}}=y\end{matrix}\right.\)
\(CH_4+2O_2\rightarrow\left(t^o\right)CO_2+2H_2O\)
x 2x x ( mol )
\(2C_4H_{10}+13O_2\rightarrow\left(t^o\right)8CO_2+10H_2O\)
y 13/2 y 4y ( mol )
Ta có:
\(\left\{{}\begin{matrix}16x+58y=7,4\\x+4y=0,5\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}x=0,1\\y=0,1\end{matrix}\right.\)
\(\Rightarrow n_{O_2}=2.0,1+\dfrac{13}{2}.0,1=0,85mol\)
\(V_{O_2}=0,85.22,4=19,04l\)
Đúng 0
Bình luận (3)
Đốt cháy hoàn toàn hỗn hợp chứa 2,4 gam Mg và 1,8 gam Al trong 2,688 lít (đktc) hỗn hợp khí gồm O2 và Cl2, sau khi kết thúc phản ứng thu được m gam hỗn hợp gồm các muối và oxit (không thấy khí thoát ra). Giá trị của m là. A. 12,44 gam B. 11,16 gam C. 8,32 gam D. 9,60 gam
Đọc tiếp
Đốt cháy hoàn toàn hỗn hợp chứa 2,4 gam Mg và 1,8 gam Al trong 2,688 lít (đktc) hỗn hợp khí gồm O2 và Cl2, sau khi kết thúc phản ứng thu được m gam hỗn hợp gồm các muối và oxit (không thấy khí thoát ra). Giá trị của m là.
A. 12,44 gam
B. 11,16 gam
C. 8,32 gam
D. 9,60 gam
Đốt cháy hoàn toàn hỗn hợp chứa 2,4 gam Mg và 1,8 gam Al trong 2,688 lít (đktc) hỗn hợp khí gồm O2 và Cl2, sau khi kết thúc phản ứng thu được m gam hỗn hợp gồm các muối và oxit (không thấy khí thoát ra). Giá trị của m là A. 12,44 gam B. 11,16 gam C. 8,32 gam D. 9,60 gam
Đọc tiếp
Đốt cháy hoàn toàn hỗn hợp chứa 2,4 gam Mg và 1,8 gam Al trong 2,688 lít (đktc) hỗn hợp khí gồm O2 và Cl2, sau khi kết thúc phản ứng thu được m gam hỗn hợp gồm các muối và oxit (không thấy khí thoát ra). Giá trị của m là
A. 12,44 gam
B. 11,16 gam
C. 8,32 gam
D. 9,60 gam
Đốt cháy hoàn toàn hỗn hợp chứa 2,4 gam Mg và 1,8 gam Al trong 2,688 lít (đktc) hỗn hợp khí gồm O2 và Cl2, sau khi kết thúc phản ứng thu được m gam hỗn hợp gồm các muối và oxit (không thấy khí thoát ra). Giá trị của m là A. 12,44 gam B. 11,16 gam C. 8,32 gam D. 9,60 gam
Đọc tiếp
Đốt cháy hoàn toàn hỗn hợp chứa 2,4 gam Mg và 1,8 gam Al trong 2,688 lít (đktc) hỗn hợp khí gồm O2 và Cl2, sau khi kết thúc phản ứng thu được m gam hỗn hợp gồm các muối và oxit (không thấy khí thoát ra). Giá trị của m là
A. 12,44 gam
B. 11,16 gam
C. 8,32 gam
D. 9,60 gam
1.Đốt cháy hoàn toàn 3,7 gam hỗn hợp khí Z gồm metan và butan (C4H10. Sau khi kết thúc phản ứng, thu được 11 gam khí CO2. Tính thành phần phần trăm theo khối lượng mỗi khí trong hỗn hợp ban đầu.
Gọi a là số mol CH4 và b là số mol C4H10.
Ta có : nCO2= 11/44 = 0,25 (mol)
Phản ứng :
CH4 + 2O2 −to→ CO2 + 2H2O (1)
(mol) a → a
C4H10 + 13/2 O2 → 4CO2 + 5H2O (2)
(mol) b → 4b
Theo đề bài, ta có hệ phương trình:
{(mZ=mCH4+ mC4H10 và nCO2= nCO(2/(1))+nCO(2/(2)) ) <→ {(16a+58b=3,7 và a+4b=0,25)
Giải hệ phương trình, ta được: a=0,05; b==0,05.
Vậy: % mCH4= 0,05x16/3,7 x 100% = 21,62%
% mC4 H10= 0,05x58/3,7 x 100% = 78,38%
Đúng 0
Bình luận (0)
Đốt cháy hoàn toàn 11,2 lít hỗn hợp x gồm metan và etilen sau đó dẫn toàn bộ sản phẩm cháy vào bình đựng nước vôi trong dư sau khi phản ứng kết thúc thấy 80 gam chất rắn và khối lượng bình nước vôi trong tăng M gam
a)Viết phương trình xảy ra
b)Tính thể tích và phần trăm thể tích mỗi khí trong hỗn hợp X
c)Tính M
Help me! Thanks<3
\(n_{hh}=\dfrac{11,2}{22,4}=0,5mol\)
Gọi \(\left\{{}\begin{matrix}n_{CH_4}=x\\n_{C_2H_4}=y\end{matrix}\right.\)
\(CH_4+2O_2\rightarrow\left(t^o\right)CO_2+2H_2O\)
x x ( mol )
\(C_2H_4+3O_2\rightarrow\left(t^o\right)2CO_2+2H_2O\)
y 2y ( mol )
\(n_{CaCO_3}=\dfrac{80}{100}=0,8mol\)
\(Ca\left(OH\right)_2+CO_2\rightarrow\left(t^o\right)CaCO_3+H_2O\)
0,8 0,8 ( mol )
Ta có:
\(\left\{{}\begin{matrix}x+y=0,5\\x+2y=0,8\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}x=0,2\\y=0,3\end{matrix}\right.\)
\(\%V_{CH_4}=\dfrac{0,2}{0,5}.100=40\%\)
\(\%V_{C_2H_4}=100\%-40\%=60\%\)
\(m_{tăng}=m_{Ca\left(OH\right)_2}+m_{CaCO_3}=0,8.\left(74+100\right)=139,2g\)
Đúng 3
Bình luận (2)