Tính số mol trong hợp chất sau:
300 gam sắt (III) sunfat F e 2 S O 4 3
Cho 20 gam sắt(III) sunfat Fe2(SO4)3 tác dụng với natri hiđroxit NaOH, thu được 10,7 gam sắt(III) hiđroxit Fe(OH)3 và 21,3 gam natri sunfat Na2SO4. Số mol natri hiđroxit tham gia vào phản ứng là :
A. 0,5 mol.
B. 9,4 mol.
C. 12 mol.
D. 0.3 mol.
Theo ĐLBTKL:
\(m_{Fe_2\left(SO_4\right)_3}+m_{NaOH}=m_{Fe\left(OH\right)_3}+m_{Na_2SO_4}\)
=> \(m_{NaOH}=10,7+21,3-20=12\left(g\right)=>n_{NaOH}=\dfrac{12}{40}=0,3\left(mol\right)\)
=> D
Ngâm một lá sắt trong 100g dung dịch đồng (III) sunfat 3,2% cho đến khi sắt ko tan đc nữa.
a) Tính khối lượng sắt phản ứng
b) Tính nồng độ % của chất trong dung dịch thu đc sau phản ứng
(biết Fe = 56; Cu = 64; S = 32; O = 16)
a) \(n_{CuSO_4}=\dfrac{100.3,2\%}{160}=0,02\left(mol\right)\)
PTHH: CuSO4 + Fe ---> FeSO4 + Cu
0,02---->0,02--->0,02----->0,02
=> mFe (pư) = 0,02.56 = 1,12 (g)
b) mdd sau pư = 100 + 1,12 - 0,02.64 = 99,84 (g)
=> \(C\%_{FeSO_4}=\dfrac{0,02.152}{99,84}.100\%=3,045\%\)
Số mol của 8 gam sắt(III) oxit (hợp chất tạo bởi Fe(III) và O ) là ( Fe = 56, O = 16 )
(25 Points)
A.0,01 mol
B.0,02 mol
C.0,05 mol
D.0,1 mol
\(CTHH:Fe_2O_3\)
\(M_{Fe_2O_3}=56.2+16.3=160\left(\dfrac{g}{mol}\right)\)
\(n_{Fe_2O_3}=\dfrac{m}{M}=\dfrac{8}{160}=0,05\left(mol\right)\\ \Rightarrow C\)
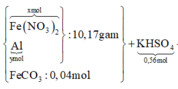
Trộn 10,17 gam hỗn hợp X gồm F e N O 3 2 và Al với 4,64 gam F e C O 3 thu được hỗn hợp Y. Cho Y tác dụng vừa đủ với dung dịch chứa 0,56 mol K H S O 4 thu được dung dịch Z chỉ chứa 83,41 gam muối sunfat trung hòa và m gam hỗn hợp khí T trong đó có 0,01 mol H 2 Cho dung dịch chứa 0,57 mol NaOH vào Z, sau phản ứng thu được dung dịch E (không chứa muối sắt, muối amoni và bazơ), kết tủa G và khí F. Nung G trong không khí đến khối lượng không đổi, thu được 11,5 gam chất rắn. Giá trị của m là
A. 2,70
B. 2,52
C. 3,42
D. 3,22
Trộn 10,17 gam hỗn hợp X gồm F e ( N O 3 ) 2 và Al với 4,64 gam F e C O 3 thu được hỗn hợp Y. Cho Y tác dụng vừa đủ với dung dịch chứa 0,56 mol K H S O 4 thu được dung dịch Z chỉ chứa 83,41 gam muối sunfat trung hòa và m gam hỗn hợp khí T trong đó có 0,01 mol H 2 Cho dung dịch chứa 0,57 mol NaOH vào Z
, sau phản ứng thu được dung dịch E (không chứa muối sắt, muối amoni và bazơ), kết tủa G và khí F. Nung G trong không khí đến khối lượng không đổi, thu được 11,5 gam chất rắn. Giá trị của m là
A. 2,70
B. 2,52
C. 3,42
D. 3,22
Trộn 10,17 gam hỗn hợp X gồm F e ( N O 3 ) 2 và Al với 4,64 gam F e C O 3 thu được hỗn hợp Y. Cho Y tác dụng vừa đủ với dung dịch chứa 0,56 mol K H S O 4 thu được dung dịch Z chỉ chứa 83,41 gam muối sunfat trung hòa và m gam hỗn hợp khí T trong đó có 0,01 mol H 2 Cho dung dịch chứa 0,57 mol NaOH vào Z, sau phản ứng thu được dung dịch E (không chứa muối sắt, muối amoni và bazơ), kết tủa G và khí F. Nung G trong không khí đến khối lượng không đổi, thu được 11,5 gam chất rắn. Giá trị của m là
A. 2,70
B. 2,52
C. 3,42
D. 3,22
Đáp án C
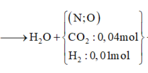
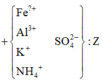
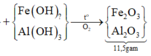
YTHH 02: Natri đi về đâu để xử lí dung dịch Z sau phản ứng
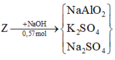
Có 0,28 mol K 2 S O 4 => 0,28 mol N a S O 4 => còn 0,01 mol N a A l O 2
Gọi x, y như sơ đồ, ta có 180x + 27y = 10,17 gam
Bảo toàn nguyên tố có:
Cuối tùng thu được ![]()
![]()
=> 160.(0,5x + 0,02) + 102.(0,5y + 0,005) = 11,5 gam
Giải hệ được: x = 0,04 mol; y = 0,11 mol
Về mặt nguyên tố, trong muối Z:![]()
=> thay số có n N H 4 = 0 , 02 m o l
=> bảo toàn nguyên tố H có n H 2 O trong sơ đồ = 0,23 mol
=> bảo toàn khối lượng có
m T = 10,17 + 4,64 + 0,56.136 - 83,41 - 0,23.18 = 3,42 gam
Tính thành phần phần trăm theo khối lƣợng của các nguyên tố trong hợp chất sau: a) Sắt(III) oxit: Fe2O3 b) Nhôm sunfat : Al2(SO4)3
a) \(\left\{{}\begin{matrix}\%Fe=\dfrac{56.2}{160}.100\%=70\%\\\%O=100\%-70\%=30\%\end{matrix}\right.\)
b) \(\left\{{}\begin{matrix}\%Al=\dfrac{27.2}{342}.100\%=15,79\%\\\%S=\dfrac{32.3}{342}.100\%=28,07\%\\\%O=\dfrac{16.12}{342}.100\%=56,14\%\end{matrix}\right.\)
mọi ngừi giúp mình với, mình cần gấpppp
1.Cho 11,2g kim loại sắt vào 300 ml dung dịch H 2 SO 4 2M.
a/ Viết phương trình phản ứng.
b/ Tính thể tích khí hidro sinh ra?
c/ Tính nồng độ mol các chất có trong dung dịch sau phản ứng?
2.Cho 14 gam hỗn hợp MgO và CuO vào 500 ml dung dịch HCl 1M. Tính khối lượng từng oxit trong hỗn hợp ban đầu.
Bài 1:
PTHH: \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\)
Ta có: \(\left\{{}\begin{matrix}n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\\n_{H_2SO_4}=0,3\cdot2=0,6\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\) Axit còn dư
\(\Rightarrow\left\{{}\begin{matrix}n_{FeSO_4}=0,2\left(mol\right)\\n_{H_2SO_4}=0,4\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}C_{M_{FeSO_4}}=\dfrac{0,2}{0,3}\approx0,67\left(M\right)\\C_{M_{H_2SO_4}}=\dfrac{0,4}{0,3}=0,75\left(M\right)\end{matrix}\right.\)
Mặt khác: \(n_{H_2}=0,2\left(mol\right)\) \(\Rightarrow V_{H_2}=0,2\cdot22,4=4,48\left(l\right)\)
Bài 2:
PTHH: \(MgO+2HCl\rightarrow MgCl_2+H_2O\)
a______2a (mol)
\(CuO+2HCl\rightarrow CuCl_2+H_2O\)
b______2b (mol)
Ta lập HPT: \(\left\{{}\begin{matrix}40a+80b=14\\2a+2b=0,5\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}a=0,15\\b=0,1\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{CuO}=0,1\cdot80=8\left(g\right)\\m_{MgO}=6\left(g\right)\end{matrix}\right.\)
4. Cho 22, 4g sắt tác dụng dd loãng chứa 24.5 H 2 SO 4 a.Viết PTHH xảy ra b. Tinh thể tích khí thu được sau phản ứng c.Tính khối lượng chất còn dư sau phản ứng Tính số mol và số gam chất tan trong các trường hợp sau:
Theo gt ta có: $n_{Fe}=0,4(mol);n_{H_2SO_4}=0,25(mol)$
$Fe+H_2SO_4\rightarrow FeSO_4+H_2$
b, Ta có: $n_{H_2}=n_{H_2SO_4}=0,25(mol)\Rightarrow V_{H_2}=5,6(l)$
c, Sau phản ứng còn dư $n_{Fe}=0,4-0,25=0,15(mol)\Rightarrow m_{Fe}=8,4(g)$
(Các trường hợp nào bạn nhỉ?)
\(n_{Fe}=\dfrac{22.4}{56}=0.4\left(mol\right)\)
\(n_{H_2SO_4}=\dfrac{24.5}{98}=0.25\left(mol\right)\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
\(1............1\)
\(0.4.........0.25\)
\(LTL:\dfrac{0.4}{1}>\dfrac{0.25}{1}\Rightarrow Fedư\)
\(V_{H_2}=0.25\cdot22.4=5.6\left(l\right)\)
\(m_{Fe\left(dư\right)}=\left(0.4-0.25\right)\cdot56=8.4\left(g\right)\)