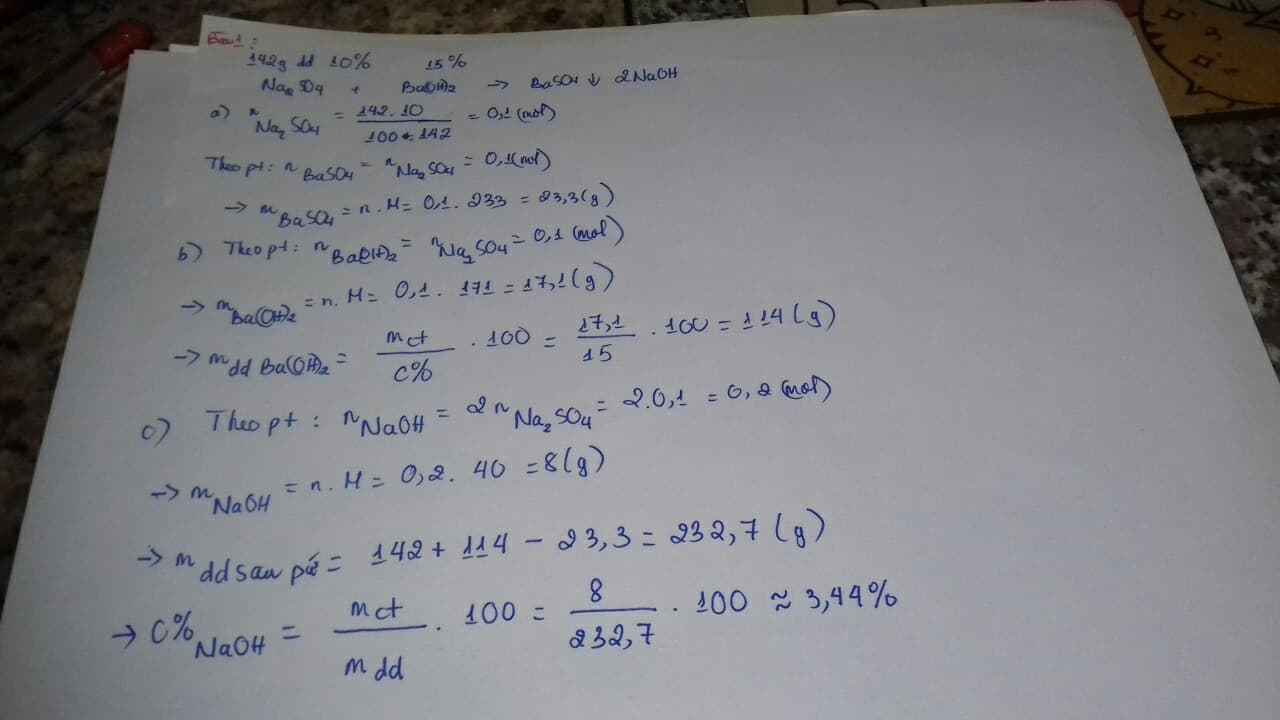Cho 34,2 g Ba(OH)2 vào 240 gam dung dịch Na2SO4. a) Viết phương trình phản ứng xảy ra. b) Tính khối lượng kết tủa thu được. c) Tính nồng độ phần trăm của dung dịch Na2SO4 đã dùng

Những câu hỏi liên quan
Trộn 1 dung dịch có hòa tan 0,1 mol CuCl2 với 200 gam dung dịch NaOH
a) Viết phương trình hóa học xảy ra
b) Tính khối lượng kết tủa thu được ?
c) Tính nồng độ phần trăm của dung dịch NaOH dùng cho phản ứng trên ?
d) Nếu sử dụng lượng NaOH gấp 3/2 lần lượng NaOH ở trên cho vào dung dịch Fe2(SO4)3 dư. Lọc lấy kết tủa đem nung đến khối lượng không đổi. Tính khối lượng chất rắn thu được sau khi nung.
Đọc tiếp
Trộn 1 dung dịch có hòa tan 0,1 mol CuCl2 với 200 gam dung dịch NaOH
a) Viết phương trình hóa học xảy ra
b) Tính khối lượng kết tủa thu được ?
c) Tính nồng độ phần trăm của dung dịch NaOH dùng cho phản ứng trên ?
d) Nếu sử dụng lượng NaOH gấp 3/2 lần lượng NaOH ở trên cho vào dung dịch Fe2(SO4)3 dư. Lọc lấy kết tủa đem nung đến khối lượng không đổi. Tính khối lượng chất rắn thu được sau khi nung.
Lấy 142 gam dung dịch Na2SO4 10% tác dụng hoàn toàn với dung dịch Ba(OH)2 15%. Tính: a. Khối lượng chất rắn thu được sau phản ứng. b. Khối lượng dung dịch Ba(OH)2 đã dùng. c. Nồng độ % của dung dịch sản phẩm. Bài 4. Hòa tan hoàn toàn 1,88 g gam K2O vào 500 ml nước thu được dung dịch A (coi như thể tích không thay đổi).
Bài 3. Lấy 142 gam dung dịch Na2SO4 10% tác dụng hoàn toàn với dung dịch Ba(OH)2 15%. Tính: a. Khối lượng chất rắn thu được sau phản ứng. b. Khối lượng dung dịch Ba(OH)2 đã dùng. c. Nồng độ % của dung dịch sản phẩm.
\(n_{Na_2SO_4}=\dfrac{142.10}{100.142}=0,1(mol)\\ Na_2SO_4+Ba(OH)_2\to BaSO_4\downarrow+2NaOH\\ \Rightarrow n_{BaSO_4}=n_{Ba(OH)_2}=0,1(mol);n_{NaOH}=0,2(mol)\\ a,m_{BaSO_4}=0,1.233=23,3(g)\\ b,m_{dd_{Ba(OH)_2}}=\dfrac{0,1.171}{15\%}=114(g)\\ c,C\%_{NaOH}=\dfrac{0,2.40}{142+114-23,3}.100\%=3,44\%\)
Đúng 2
Bình luận (8)
Ta có: \(n_{Na_2SO_4}=\dfrac{\dfrac{10\%.142}{100\%}}{142}=0,1\left(mol\right)\)
\(PTHH:Na_2SO_4+Ba\left(OH\right)_2--->BaSO_4\downarrow+2NaOH\)
a. Theo PT: \(n_{BaSO_4}=n_{Ba\left(OH\right)_2}=n_{Na_2SO_4}=0,1\left(mol\right)\)
\(\Rightarrow m_{BaSO_4}=0,1.233=23,3\left(g\right)\)
b. Ta có: \(m_{Ba\left(OH\right)_2}=0,1.171=17,1\left(g\right)\)
Mà: \(C_{\%_{Ba\left(OH\right)_2}}=\dfrac{17,1}{m_{dd_{Ba\left(OH\right)_2}}}.100\%=15\%\)
\(\Leftrightarrow m_{dd_{Ba\left(OH\right)_2}}=114\left(g\right)\)
c. Ta có: \(m_{dd_{NaOH}}=114+14,2-23,3=104,9\left(g\right)\)
Theo PT: \(n_{NaOH}=2.n_{Ba\left(OH\right)_2}=2.0,1=0,2\left(mol\right)\)
\(\Rightarrow m_{NaOH}=0,2.40=8\left(g\right)\)
\(\Rightarrow C_{\%_{NaOH}}=\dfrac{8}{104,9}.100\%=7,63\%\)
Đúng 1
Bình luận (0)
Giúp mình với ạ Cho 200 ml dung dịch muối natri sufat (Na2SO4)0.2M vào 200ml dung dịch Ba(OH)2 0.1M a) viết phương trình phản ứng hóa học xảy ra b) Tính nồng độ mol các chất trong dung dịch thu được sau phản ứng
\(a,n_{Na_2SO_4}=0,2\cdot0,2=0,04\left(mol\right);n_{Ba\left(OH\right)_2}=0,2\cdot0,1=0,02\left(mol\right)\\ PTHH:Na_2SO_4+Ba\left(OH\right)_2\rightarrow2NaOH+BaSO_4\downarrow\\ TL:....1.....1......2......1\left(mol\right)\\ BR:.......0,02.....0,02......0,04......0,02\left(mol\right)\)
Vì \(\dfrac{n_{Na_2SO_4}}{1}>\dfrac{n_{Ba\left(OH\right)_2}}{1}\) nên \(Na_2SO_4\) dư, \(Ba\left(OH\right)_2\) hết
\(b,C_{M_{NaOH}}=\dfrac{0,04}{0,2+0,2}=0,1M\)
Đúng 0
Bình luận (0)
Cho 5 ml dung dịch na2so4 1M vào 30 ml dung dịch BaCl2 1M. a) viết phương trình hóa học. b) tính khối lượng kết tủa thu được. c) tính nồng độ mol của các chất trong dung dịch sau phản ứng ( ko tính thay đổi đáng kể )
Giải giúp e vs ạ e cảm ơn
Bài 2: Cho 200ml dung dịch Na2CO3 1M tác dụng vừa đủ với 200 gam dung dịch Ba (OH) 2 . a. Viết PTHH xảy ra. b. Tính khối lượng chất kết tủa thu được. c. Tính nồng độ % của dung dịch Ba (OH) 2 dùng cho phản ứng trên.
a.
\(Na_2CO_3+Ba\left(OH\right)_2\rightarrow BaCO_3+2NaOH\)
b.
\(n_{BaCO_3}=n_{Na_2CO_3}=0,2.1=0,2\left(mol\right)\\ m_{kt}=197.0,2=39,4\left(g\right)\)
c.
\(n_{Ba\left(OH\right)_2}=n_{Na_2CO_3}=0,2\left(mol\right)\\ C\%_{Ba\left(OH\right)_2}=\dfrac{0,2.171.100\%}{200}=17,1\%\)
Đúng 3
Bình luận (0)
Cho MgO tác tác dụng vừa đủ với 200 gam dung dịch axide H2SO4 9,8% Đến khi phản ứng kết thúc thì thu được dung dịch A a) viết phương trình hóa học xảy ra b) tính khối lượng MgO đã tham gia phản ứng C) tính nồng độ phần trăm của dung dịch thu được sau phản ứng
a, \(MgO+H_2SO_4\rightarrow MgSO_4+H_2O\)
b, Ta có: \(m_{H_2SO_4}=200.9,8\%=19,6\left(g\right)\)
\(\Rightarrow n_{H_2SO_4}=\dfrac{19,6}{98}=0,2\left(mol\right)\)
Theo PT: \(n_{MgO}=n_{MgSO_4}=n_{H_2SO_4}=0,2\left(mol\right)\)
\(\Rightarrow m_{MgO}=0,2.40=8\left(g\right)\)
c, Ta có: m dd sau pư = 8 + 200 = 208 (g)
\(\Rightarrow C\%_{MgSO_4}=\dfrac{0,2.120}{208}.100\%\approx11,54\%\)
Đúng 1
Bình luận (0)
câu 1: có 2 lọ mất nhãn đựngcác dung dịch sau : CuSO4 và Na2SO4.Hãy trình bày phương pháp hóa học để nhận biết 2 chất trên ( viết PTHH nếu có)câu 2: cho 500 ml dung dịch MgCl2 tác dụng vừa đủ với 30g NaOH. Phản ứng xong tiếp tục nung lấy kết tủa đến khối lượng không đổi thì thu được 1 chất rắn. Hãy: a, Viết phương trình phản ứng xảy ra b, Tính khối lượng chất rắn thu được sau khi nung kết tủa c, Tính nồng độ mol của MaCl2 đã dùng
Đọc tiếp
câu 1: có 2 lọ mất nhãn đựngcác dung dịch sau : CuSO4 và Na2SO4.Hãy trình bày phương pháp hóa học để nhận biết 2 chất trên ( viết PTHH nếu có)
câu 2: cho 500 ml dung dịch MgCl2 tác dụng vừa đủ với 30g NaOH. Phản ứng xong tiếp tục nung lấy kết tủa đến khối lượng không đổi thì thu được 1 chất rắn. Hãy:
a, Viết phương trình phản ứng xảy ra
b, Tính khối lượng chất rắn thu được sau khi nung kết tủa
c, Tính nồng độ mol của MaCl2 đã dùng
câu 1
cho 2dd trên td vs NaOH dư
có tủa => CuSO4
CuSO4 + 2NaOH => Na2SO4 + Cu(OH)2
ko hiện tượng => Na2SO4
Đúng 0
Bình luận (2)
câu 2
nNaOH = 0,75
MgCl2 + 2NaOH => 2NaCl + Mg(OH)2
0,375<---- 0,75--------> 0,75---> 0,375
=> mcr = 0,375. 58 = 21,75 (g)
CM MgCl2 = 0,375/0,5 = 0,75M
Đúng 1
Bình luận (1)
Cho 200ml dung dịch Ba(OH)2 0,5M tác dụng với 300ml dung dịch H2SO4 0,4M. a. Viết phương trình hóa học xảy ra. b. Tính nồng độ mol và nồng độ phần trăm của dung dịch thu được sau phản ứng. Giả sử khối lượng riêng của hai dung dịch Ba(OH)2 và H2SO4 lần lượt bằng 2,3g/cm3 và 1,6g/cm3.
\(n_{Ba\left(OH\right)_2}=0,5.0,2=0,1\left(mol\right);n_{H_2SO_4}=0,3.0,4=0,12\left(mol\right)\)
PTHH: Ba(OH)2 + H2SO4 → BaSO4↓ + 2H2O
Mol: 0,1 0,1 0,1
Ta có: \(\dfrac{0,1}{1}< \dfrac{0,12}{1}\) ⇒ Ba(OH)2 hết, H2SO4 dư
\(C_{M_{H_2SO_4dư}}=\dfrac{0,12-0,1}{0,2+0,3}=0,04M\)
mdd sau pứ = 200.2,3+300.1,6-0,1.233 = 916,7 (g)
\(C\%_{H_2SO_4dư}=\dfrac{0,02.98.100\%}{916,7}=0,21\%\)
Đúng 0
Bình luận (0)