Tính pH của các dung dịch sau:
a) Dung dịch A: H2SO4 0,01M.
b) Dung dịch B: NaOH 0,01M.
c) Dung dịch C: tạo bởi dung dịch A trộn với dung dịch B theo tỉ lệ tương ứng là 1:2.
Help me
Trộn 200ml dung dịch H2SO4 0,01M vào 100ml dung dịch NaOH 0,01M. Tính pH của dung dịch X sau phản ứng
\(n_{H^+}=0.2\cdot0.01\cdot2=0.004\left(mol\right)\)
\(n_{OH^-}=0.1\cdot0.01=0.001\left(mol\right)\)
\(H^++OH^-\rightarrow H_2O\)
\(0.001.....0.001\)
\(n_{H^+\left(dư\right)}=0.004-0.001=0.003\left(mol\right)\)
\(pH=-log\left(H^+\right)=-log\left(\dfrac{0.003}{0.2+0.1}\right)=2\)
Có: \(n_{H^+}=2n_{H_2SO_4}=2.0,2.0,01=0,004\left(mol\right)\)
\(n_{OH^-}=0,1.0,01=0,001\left(mol\right)\)
PT ion: \(H^++OH^-\rightarrow H_2O\)
____0,004___0,001 (mol)
\(\Rightarrow n_{H^+\left(dư\right)}=0,003\left(mol\right)\)\\(\Rightarrow\left[H^+\right]=\dfrac{0,003}{0,3}=0,01\)
\(\Rightarrow pH=2\)
Bạn tham khảo nhé!
A là dung dịch HCl 0,01M ; B là dung dịch hỗn hợp gồm NaOH 0,01M và Ba(OH)2 0,015M .
a/ Hãy tính pH của dung dịch A và pH của dung dịch B .
b/ Hãy tính pH của dung dịch thu được khi trộn 300ml dung dịch A với 100 ml dung dịch B .
HELP ME !!!!!
mọi người giúp e với ạ
Tính pH:
a) cho 500ml dung dịch H2SO4 0,01M + 300ml dung dịch HNO3 0,02
b) cho 500ml dung dịch Ca(OH)2 0,01M + 300ml dung dịch NaOH 0,02M
c) cho 500ml dung dịch Ca(OH)2 0,01M + 300ml dung dịch H2SO4 0,01M
Cho A là dung dịch H2SO4 ; B1, B2 là ha dung dịch NaOH có nồng độ khác nhau. Trộn B1 với B2 theo tỉ lệ thể tịch 1: 1 thu được dung dịch X. Trung hòa 20 ml dung dịch X cần dùng 20 ml dung dịch A. Trộn B1 với B2 theo tỉ lệ thể tích tương ứng 2: 1 thu được dung dịch Y. Trung hòa 30 ml dung dịch Y cần dùng 32,5 ml dung dịch A. Trộn B1 với B2 theo tỉ lệ thể tích tương ứng a: b thu được dung dịch Z. Trung hòa 70 ml dung dịch Z cần dùng 67,5 ml dung dịch A. Tìm giá trị a : b.
A: H2SO4 : CA (M)
B1: NaOH : C1 (M)
B2: NaOH: C2 (M)
TH1: VB1: VB2 = 1: 1 => gọi thể tích của mỗi chất là V
Nồng độ của NaOH sau khi trộn là: CM = n : V
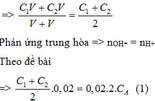
TH2: VB1 : VB2 = 2 : 1 => Đặt VB2 = V (lít) thì VB1 = 2V (lít)
Nồng độ của NaOH sau khi trộn là:

Ta có:
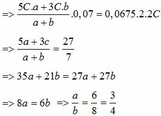
Trộn 100ml dung dịch NaOH 0,01M với 200ml dung dịch HCl 0,01M. Tính pH của dung dịch thu được sau phản ứng
Dung dịch X là dung dịch H2SO4, dung dịch Y là dung dịch NaOH. Nếu trộn X và Y theo tỉ lệ thể tích tương ứng là 3 : 2 thì thu được dung dịch A có tính axit. Để trung hoà 1 lít dung dịch A cần dùng 40 gam NaOH 20%. Nếu trộn X và Y theo tỉ lệ thể tích tương ứng 2 : 3 thì thu được dung dịch B có tính kiềm. Để trung hoà 1 lít dung dịch B cần dùng 29,2 gam HCl 25%. Tính nồng độ các dung dịch X và Y.
Đụ má đăng gần 5 tháng dell ai trả lời, web dead mẹ r
2/ Tính pH của các dung dịch sau: a) Dung dịch NaOH 0,01M b) Dung dịch Ba(OH)2 0,005M
a.
\(pH=14+log\left[OH^-\right]=14+log\left(0.01\right)=12\)
b.
\(pH=14+log\left[OH^-\right]=14+log\left(0.005\cdot2\right)=12\)
Trộn 100ml dung dịch axit HCl 0,01M với 200ml dung dịch NaOH 0,5M thu được dung dịch A sau phản ứng.Viết phương trình phân tử và ion rút gọn của phản ứng và tính pH của dung dịch sau phản ứng.
a)
$NaOH + HCl \to NaCl + H_2O$
$OH^- + H^+ \to H_2O$
b)
$n_{HCl} = 0,1.0,01 = 0,001(mol)$
$n_{NaOH} = 0,2.0,5= 0,1(mol)$
$\Rightarrow$ NaOH dư, HCl hết
$n_{NaOH\ pư} = 0,001 \Rightarrow n_{NaOH\ dư} = 0,1 - 0,001 = 0,099(mol)$
$\Rightarrow [OH^-] = \dfrac{0,099}{0,1 + 0,2} = 0,33M$
$\Rightarrow pOH = -log(0,33) = 0,48 $
$pH = 14 - pOH = 14 - 0,48 = 13,52$