hòa tan hoàn toàn 8g oxit của kim loại hóa trị III trong 30ml SO4 loãng 1M, sau phản ứng phải dùng 50g dung dịch NAOH 24% để trung hòa lượng axit còn dư. Tìm CTHH của oxit kim loại
ai giúp với
a) để hòa tan hoàn toàn 8 g oxit một kim loại R cần dùng 10,95 g HCl .hỏi R là kim loại gì ?
b) hòa tan hoàn toàn 1,44 g kim loại hóa trị 2 bằng dung dịch H2SO4 loãng chứa 7,35 g H2SO4 để phản ứng hết lượng dư axit người ta phải dùng 1,3 g NaOH sau phản ứng thu được muối Natrisunjat và nước . viết PTHH và xác định kim loại đem dùng
a) CT : R2On
nHCl = 10.95/36.5 = 0.3 (mol)
R2On + 2nHCl => 2RCln + nH2O
0.15/n_____0.3
M= 8/0.15/n = 160n/3
=> 2R + 16n = 160n3
=> 2R = 112n/3
BL : n 3 => R = 56
R là : Fe
b)2NaOH + H2SO4 => Na2SO4 + H2O
nH2SO4(bđ) = 7.36/98 = 0.075 (mol)
nNaOH = 1.3/40 = 0.0325 (mol)
=> nH2SO4(pư) = 0.075 - 0.0325/2 = 0.05875 (mol)
R + H2SO4 => RSO4 + H2
0.05875_0.05875
M = 1.44/0.05875= 24
R là : Mg
Chúc bạn học tốt !!!
\(H_2SO_4 + 2NaOH \to Na_2SO_4 + 2H_2O\\ n_{H_2SO_4\ dư} = \dfrac{1}{2}n_{NaOH} = \dfrac{1}{2}.\dfrac{50.24\%}{40} = 0,15(mol)\\ \Rightarrow n_{H_2SO_4\ pư} = 0,3 - 0,15 = 0,15(mol)\)
Oxit kim loại hóa trị III : R2O3
\(R_2O_3 + 3H_2SO_4 \to R_2(SO_4)_3 + 3H_2O\\ n_{Oxit} = \dfrac{1}{3}n_{H_2SO_4} = 0,05(mol)\\ \Rightarrow M_{oxit} = 2R + 16.3 = \dfrac{8}{0,05} = 160\\ \Rightarrow R = 56(Fe)\)
Vậy oxit cần tìm : Fe2O3
Hoà tan 3,2g Oxit kim loại hoá trị III bằng 200g dung dịch H2SO4 loãng. Khi thêm vào hoà tan 1 oxit kim loai htri IV biết rằng hoà tan 8g oxit này bằng 300ml dd H2SO4 1M. sau p/ứ trung hoà lượng axit còn dư bằng 50g dd NaOH 24%. tìm cthỗn hợp sau phản ứng 1 lượng CaCO3 vừa đủ thấy 0,0224dm3 CO2 ở đktc sau đó cô cạn dung dịch thu được 9,36g muối sunfat khô. Tìn công thức õit kim loại và C% H2SO4
Hòa tan 1,44g một kim loại hóa trị II trong 150ml axit H2SO4 0,5M. Để trung hòa axit dư phải dùng 30ml dung dịch NaOH 1M. Xác định kim loại đó?
A. Ba
B. Ca
C. Mg
D. Be
Đáp án C
nH+ pứ KL = 2nH2SO4 – nNaOH = 0,12 mol = 2nKL
=> nKL = 0,06 mol => MKL = 24g (Mg)
Hòa tan hoàn toàn 24 gam một kim loại hóa trị 2 trong 750 ml H2SO4 1M. Để trung hòa axit dư trong dung dịch thu được phải dùng hết 150 ml dung dịch NaOH 2M. xác định kim loại
\(n_{NaOH} = 0,15.2 = 0,3(mol)\\ 2NaOH + H_2SO_4 \to Na_2SO_4 + 2H_2O\\ n_{H_2SO_4\ dư} = \dfrac{1}{2}n_{NaOH} = 0,15(mol)\\ n_{H_2SO_4\ pư} = 0,75 - 0,15 = 0,6(mol)\\ \)
Gọi kim loại cần tìm là R
\(R + H_2SO_4 \to RSO_4 + H_2\\ n_R = n_{H_2SO_4} = 0,6(mol)\\ \Rightarrow M_R = \dfrac{24}{0,6} =40(Ca)\)
Vậy kim loại cần tìm là Canxi
Hòa tan hoàn toàn 20,4g oxit kim loại A hóa trị III trong 30ml dung dịch axit H2SO4 thì thu được 68,4 muối khan. Tìm công thức của oxit trên.
*trình bày chi tiết giúp mình với ạ
PT:
A2O3 + 3H2SO4 \(\rightarrow\) A2(SO4)3 + 3H2O (1)
Gọi naxit phản ứng = x (mol)
Theo đlbtkl, ta có:
moxit + maxit (pư) = mmuối + mnước
\(\Rightarrow\) maxit (pư) - mnước = mmuối - moxit
\(\Rightarrow\) 98x - 18x = 68,4 - 20,4 = 48 (g)
\(\Rightarrow\) 80x = 48
\(\Rightarrow\) x = 0,6(mol)
Theo phương trình (1) => noxit = \(\dfrac{1}{3}n_{axit}\) = 0,2(mol)
\(\Rightarrow\) \(M_{A_2O_3}\) \(\dfrac{m}{n}=\dfrac{20,4}{0,2}=102\) => Cthh của oxit là Al2O3
gọi CT oxit là R2O3.MR=R(g/mol)
R2O3+3H2SO4-->R2(SO4)3+3H2O
noxit=nmuối
<==>20,4/2R+48=64,8/2R+96
=> R= 27 (Al)
=> Oxit là Al2O
chúc bạn học tốt và nhớ tích đúng cho mình nha
Hòa tan hoàn toàn 1,44 gam kim loại hóa trị II trong 200 ml dung dịch H2SO4 0,5M. Để trung hòa lượng axit dư phải dùng hết 80 ml dung dịch KOH 1M. Kim loại cần tìm là
A. Magie
B. Canxi
C. Bari
D. Beri
Hòa tan hoàn toàn 1,44 gam kim loại hóa trị II trong 200 mL dung dịch H2SO4 0,5M. Để trung hòa lượng axit dư phải dùng hết 80 mL dung dịch KOH 1M. Kim loại cần tìm là
A. Magie.
B. Canxi.
C. Bari.
D. Beri.
Hòa tan hoàn toàn 1,44 gam kim loại hóa trị II trong 200 mL dung dịch H2SO4 0,5M. Để trung hòa lượng axit dư phải dùng hết 80 mL dung dịch KOH 1M. Kim loại cần tìm là
A. Magie.
B. Canxi.
C. Bari.
D. Beri.
Đáp án A
M + H2SO4 → MSO4 + H2 (1)
2KOH + H2SO4 → K2SO4 + 2H2O (2)
![]()
Mà
![]()
![]()
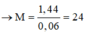
M là Magie