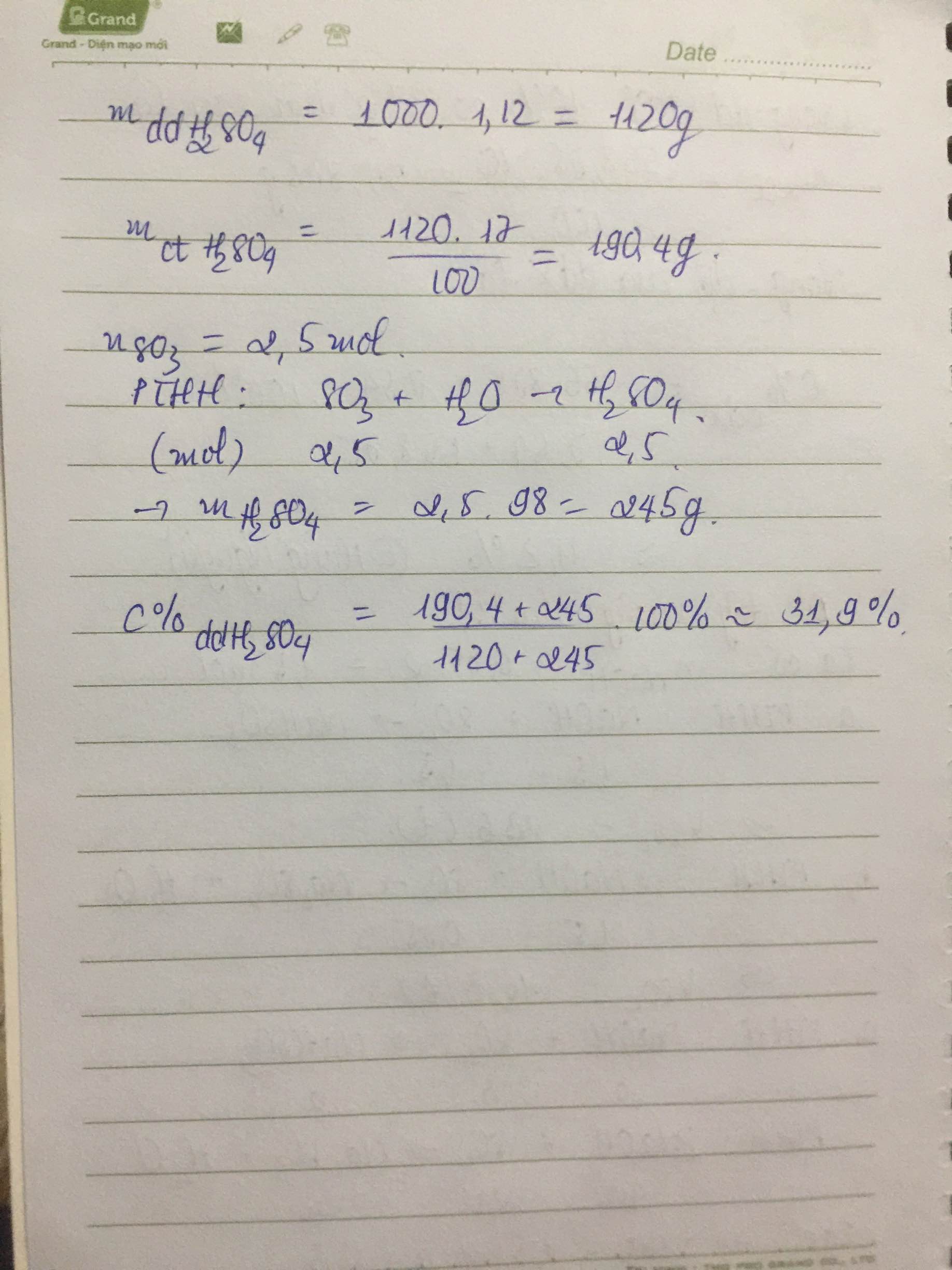Dẫn 7,62 lít SO3 (đktc) vào nước Tính C% của dd thu được

Những câu hỏi liên quan
Bài 6. a,Cho 12,4g Na2O vào 500ml nước.Tính nồng độ mol của dd thu được b,Dẫn 3,36 lít khí SO3 vào 500g nước.Tính C% của dd thu được c,Cho 8g SO2 tác dụng với nước tạo thành 500ml dd.Xác định nồng độ mol của dd thu được d,Cho 11,2g CaO vào 200ml nước.Tính nồng độ mol của dd...
Đọc tiếp
Bài 6. a,Cho 12,4g Na2O vào 500ml nước.Tính nồng độ mol của dd thu được b,Dẫn 3,36 lít khí SO3 vào 500g nước.Tính C% của dd thu được c,Cho 8g SO2 tác dụng với nước tạo thành 500ml dd.Xác định nồng độ mol của dd thu được d,Cho 11,2g CaO vào 200ml nước.Tính nồng độ mol của dd thu được e,Cho 14,2g P2O5 tác dụng với nước.Tính nồng độ mol của dd axit thu đc Bài 10.Nhúng thanh Fe vào 200ml dd CuSO4 1M đến khi phản ứng xong a,Tính khối lượng Fe phản ứng và khối lượng Cu tạo thành b,Nếu toàn bộ lượng Cu bám vào thanh Fe thì khối lượng thanh sắt tăng hay giảm bao nhiêu gam
Giúp mình với!Mình đang cần gấp
\(a.Na_2O+H_2O->2NaOH\\ C_M=\dfrac{\dfrac{12,4}{62}\cdot2}{0,5}=0,8M\\ b.SO_3+H_2O->H_2SO_4\\ C\%=\dfrac{\dfrac{3,36}{22,4}\cdot98}{\dfrac{3,36}{22,4}\cdot80+500}=2,87\%\\ c.SO_2+H_2O\leftrightarrow H_2SO_3\\ C_M=\dfrac{\dfrac{8}{64}}{0,5}=0,25M\\ d.CaO+H_2O->Ca\left(OH\right)_2\\ C_M=\dfrac{\dfrac{11,2}{56}}{0,2}=1M\\ e.P_2O_5+3H_2O->2H_3PO_4\\ C_M=\dfrac{\dfrac{14,2g}{142g\cdot mol^{^{ }-1}}}{V_{H_2O}\left(L\right)}=\dfrac{0,1mol}{V_{H_2O}\left(L\right)}\left(mol\cdot L^{^{ }-1}\right)\)
Câu e chưa có dữ kiện thể tích nước, thế số vào là ra kết quả nhé.
Đúng 1
Bình luận (0)
\(10.\\ Fe+CuSO_4->FeSO_4+Cu\\ n_{Cu}=n_{Fe}=0,2mol\\ m_{Fe\left(pu\right)}=0,2\cdot56=11,2g\\ m_{Cu}=0,2\cdot64=12,8g\\ b.\Delta m\uparrow=0,2\left(64-56\right)=1,6g\)
Đúng 1
Bình luận (0)
Dẫn 4,48 lít khí HCl (đktc) vào 2 lít nước thu được 2 lit dd có pH là
A. 3
B. 2
C. 1
D. 1,5
Đáp án C
nHCl = 0,2 mol => CHCl = 0,1 mol = CH+
=> pH = 1
Đúng 0
Bình luận (0)
Bài 6. Cho 7,75g natri oxit tác dụng với nước, thu được 250ml dd bazơ.
a.Tính nồng độ mol của dd bazơ thu được.
b.Tính khối lượng dd H2SO4 20% cần dùng để trung hòa hết lượng bazơ nói trên.
c. Dẫn V lít khí sunfurơ (ở đktc) vào dd bazơ trên. Tính V và khối lượng muối thu được sau khi phản ứng xảy ra hoàn toàn.
a) \(n_{Na_2O}=\dfrac{7,75}{62}=0,125\left(mol\right)\)
PTHH: Na2O + H2O --> 2NaOH
_____0,125------------->0,25
\(C_{M\left(NaOH\right)}=\dfrac{0,25}{0,25}=1M\)
b)
PTHH: 2NaOH + H2SO4 --> Na2SO4 + 2H2O
_______0,25---->0,125
=> mH2SO4 = 0,125.98 = 12,25(g)
=> \(m_{dd}=\dfrac{12,25.100}{20}=61,25\left(g\right)\)
Đúng 2
Bình luận (0)
Dẫn V lít khí C O 2 ở đktc vào 0,3 lít dd C a ( O H ) 2 0,02M thì thu được 0,2 gam kết tủa. Tính giá trị của V.
Hấp thụ 4,48 l khí SO3 ở đktc vào nước được 100 ml dd A.
a) Tính nồng độ mol của dd A.
b) Dd A hòa tan vừa đủ 7,28g hỗn hợp B gồm MgO, Al2O3. Sau phản ứng thu được dd C. Tính % khối lượng các chất có trong hỗn hợp B, Cm muối trong dd C.
nSO3=0,2mol
PTHH: SO3+H2O=> H2SO4
0,2--------------->0,2
=> Cm H2SO4=0,2:0,1=0,2M
b) bạn gọi x,y là lần lượt là số mon của từng chất trong B
rồi viết PTHH: từ PTHH rồi lập ra hệ pt
rồi gải x,y là xong rồi
Đúng 0
Bình luận (0)
Dẫn V lít SO2(đktc) vào dd NaOH thu được 6,3 g NA2SO3 và 1 g NaOH dư . Tính V
2NaOH + SO2 ---> Na2SO3 + H2O
n Na2SO3 =\(\dfrac{6,3}{126}\) =0,05 mol => nSO2 = nNaSO3 =0,05 mol
nNaOH = \(\dfrac{1}{40}\)=0,025 mol
=> VSO2= 0,05 *22,4 = 1,12 l
Đúng 2
Bình luận (0)
\(2NaOH + SO_2 \to Na_2SO_3 + H_2O\\ n_{SO_2} = n_{Na_2SO_3} = \dfrac{6,3}{126} = 0,05(mol)\\ V_{SO_2} = 0,05.22,4 = 1,12(lít)\)
Đúng 2
Bình luận (0)
Trộn 200g SO3 vào 1 lít dd H2SO4 17% có KLR D= 1,12 g/ml. Tính nồng độ % của dd H2SO4 thu được
Cho một lượng khí SO3 vào dd BaCl2 20% thu được 58,25g chất kết tủa màu trắng. Hỏi:
a. Tính thể tích khí SO3 phản ứng ( đktc)?
b. Tính nồng độ phần trăm của dd sau phản ứng?
\(n_{BaSO_4}=\dfrac{58.25}{233}=0.25\left(mol\right)\)
\(BaCl_2+SO_3+H_2O\rightarrow BaSO_4+2HCl\)
\(0.25........0.25.......................0.25........0.5\)
\(V_{SO_3}=0.25\cdot22.4=5.6\left(l\right)\)
\(m_{dd_{BaCl_2}}=\dfrac{0.25\cdot208}{20\%}=260\left(g\right)\)
\(m_{dd}=m_{SO_3}+m_{dd_{BaCl_2}}-m_{BaSO_4}=0.25\cdot80+260-58.25=221.75\left(g\right)\)
\(C\%_{HCl}=\dfrac{0.5\cdot36.5}{221.75}\cdot100\%=8.2\%\)
Đúng 4
Bình luận (0)
a, Cho m gam bột sắt vào dd HCl dư. Sau phản ứng thu được 3,36 lít khí ở đktc. Tính gtri của m.
b, Hòa tan hoàn toàn 6,2 gam Na2O vào nước dư thu được 500ml dd A. Tính nồng độ mol của dd A.
a, \(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(n_{Fe}=n_{H_2}=0,15\left(mol\right)\Rightarrow m_{Fe}=0,15.56=8,4\left(g\right)\)
b, \(n_{Na_2O}=\dfrac{6,2}{62}=0,1\left(mol\right)\)
\(Na_2O+H_2O\rightarrow2NaOH\)
\(n_{NaOH}=2n_{Na_2O}=0,2\left(mol\right)\Rightarrow C_{M_{NaOH}}=\dfrac{0,2}{0,5}=0,4\left(M\right)\)
Đúng 2
Bình luận (0)
\(a,n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
PTHH:
\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
0,15 0,3 0,15 0,15
\(m_{Fe}=0,15.56=8,4\left(g\right)\)
\(a,n_{Na_2O}=\dfrac{6,2}{62}=0,1\left(mol\right)\)
PTHH :
\(Na_2O+H_2O\rightarrow2NaOH\)
0,1 0,1 0,2
\(C_{M\left(A\right)}=\dfrac{0,2}{0,5}=0,4\left(M\right)\)
Đúng 2
Bình luận (0)