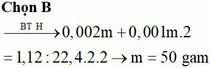hòa tan hoàn toàn 31 gam hỗn hợp X gồm 3 kim loại Cu, Mg và Al cần vừa đủ 14,56l Cl2 (đktc). Nếu hòa tan cũng lượng hỗn hợp X trên cần vừa đủ V lít O2 (đktc). Tính V

Những câu hỏi liên quan
Hòa tan hoàn toàn 11,84 gam hỗn hợp X gồm Mg và Fe cần vừa đủ 146 gam dung dịch HCl 14% thu được dung dịch Y và thoát ra V lít khí H2 (đktc).
a. Tính % khối lượng mỗi kim loại trong hỗn hợp ban đầu. b. Tính V c. Tính nồng độ phần trăm của muối trong dung dịch Y
a) Gọi số mol Mg, Fe là a, b (mol)
=> 24a + 56b = 11,84
\(n_{HCl}=\dfrac{146.14\%}{36,5}=0,56\left(mol\right)\)
PTHH: Mg + 2HCl --> MgCl2 + H2
a--->2a--------->a----->a
Fe + 2HCl --> FeCl2 + H2
b-->2b-------->b------>b
=> 2a + 2b = 0,56
=> a = 0,12; b = 0,16
=> \(\left\{{}\begin{matrix}\%Mg=\dfrac{0,12.24}{11,84}.100\%=24,324\%\\\%Fe=\dfrac{0,16.56}{11,84}.100\%=75,676\%\end{matrix}\right.\)
b) \(n_{H_2}=a+b=0,28\left(mol\right)\)
=> \(V_{H_2}=0,28.22,4=6,272\left(l\right)\)
c) mdd sau pư = 11,84 + 146 - 0,28.2 = 157,28 (g)
=> \(\left\{{}\begin{matrix}C\%_{MgCl_2}=\dfrac{0,12.95}{157,28}.100\%=7,25\%\\C\%_{FeCl_2}=\dfrac{0,16.127}{157,28}.100\%=12,92\%\end{matrix}\right.\)
Đúng 2
Bình luận (0)
Hòa tan hoàn toàn m gam hỗn hợp X gồm Mg và Al cần vừa đủ 100 gam dung dịch HCl x% thu được dung dịch Y và thoát ra 2,576 lít khí H2 (đktc). Cô cạn dung dịch Y thu được 10,475 gam muối.
a. Tính % khối lượng mỗi kim loại trong hỗn hợp ban đầu.
b. Tính x
\(a,n_{H_2}=\dfrac{2,576}{22,4}=0,115\left(mol\right)\\ Đặt:n_{Mg}=a\left(mol\right);n_{Al}=b\left(mol\right)\left(a,b>0\right)\\ Mg+2HCl\rightarrow MgCl_2+H_2\\ 2Al+6HCl\rightarrow2AlCl_3+3H_2\\ \Rightarrow\left\{{}\begin{matrix}95a+133,5b=10,475\\a+1,5b=0,115\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,04\\b=0,05\end{matrix}\right.\\ \%m_{Mg}=\dfrac{0,04.24}{0,04.24+0,05.27}.100\approx41,558\%\Rightarrow\%m_{Al}\approx58,442\%\\ b,n_{HCl}=2.n_{H_2}=2.0,115=0,23\left(mol\right)\\ \Rightarrow x=C\%_{ddHCl}=\dfrac{0,23.36,5}{100}.100=8,395\%\)
Đúng 2
Bình luận (0)
Hòa tan 9,1 gam hỗn hợp X gồm hai kim loại Al và Cu vài 300 ml dung dịch HCl 1M vừa đủ đến khi phản ứng xảy ra hoàn toàn thu được V lít khí H2 do ở đktc. a. Tính khối lượng mỗi kim loại trong hỗn hợp ban đầu b. Tính V
\(n_{HCl}=0,3.1=0,3mol\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
0,1 0,3 0,15 ( mol )
\(m_{Al}=0,1.27=2,7g\)
\(\Rightarrow m_{Al}=9,1.2,7=6,4g\)
\(V_{H_2}=0,15.22,4=3,36l\)
Đúng 3
Bình luận (2)
nHCl = 0,3 . 1 = 0,3 (mol)
PTHH: 2Al + 6HCl -> 2AlCl3 + 3H2
Mol: 0,1 <--- 0,3 ---> 0,1 ---> 0,15
mAl = 0,1 . 27 = 2,7 (g(
mCu = 9,1 - 2,7 = 6,4 (g)
VH2 = 0,15 . 22,4 = 3,36 (l)
Đúng 2
Bình luận (1)
Đề: Đốt cháy hoàn toàn 6,3 gam hỗn hợp X gồm kim loại Mg và Al (tỉ lệ tương ứng 3 : 2) cần dùng vừa đủ V lít khí O2 (đktc), thu được hỗn hợp Y gồm hai oxit bazo.
a. Tính khối lượng mỗi oxit trong Y.
b. Tính giá trị V.
PTHH: \(2Mg+O_2\underrightarrow{t^o}2MgO\) (1)
\(4Al+3O_2\underrightarrow{t^o}2Al_2O_3\) (2)
a) Gọi số mol của Mg là a (mol) \(\Rightarrow n_{Al}=\dfrac{2}{3}a\left(mol\right)\)
\(\Rightarrow24a+27\cdot\dfrac{2}{3}a=6,3\) \(\Rightarrow a=0,15\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}n_{MgO}=0,15\left(mol\right)\\n_{Al_2O_3}=0,05\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}m_{MgO}=0,15\cdot40=6\left(g\right)\\m_{Al_2O_3}=0,05\cdot102=5,1\left(g\right)\end{matrix}\right.\)
b) Theo các PTHH: \(\left\{{}\begin{matrix}n_{O_2\left(1\right)}=0,075\left(mol\right)\\n_{O_2\left(2\right)}=0,075\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\Sigma n_{O_2}=0,15\left(mol\right)\) \(\Rightarrow V_{O_2}=0,15\cdot22,4=3,36\left(l\right)\)
Đúng 1
Bình luận (0)
đốt cháy hoàn toàn 11 gam hỗn hợp kim loại gồm Na và Cu cần vừa đủ 2,24 lít O2 (đktc) thu được hỗn hợp chất rắn A gồm Na2O và CuO. Hòa tan hoàn toàn A vào 200ml nước thu được dung dịch B và chất rắn không tan C.a) Viết phương trình phản ứng và tính khối lượng mỗi chất ban đầu.b) tính nồng độ mol/l và nồng độ phần trăm của chất tan có trong dung dịch B.( Coi thể tích dung dịch không thay đổi không đáng kể trong quá trình thí nghiệm, DH2O 1g/ml)
Đọc tiếp
đốt cháy hoàn toàn 11 gam hỗn hợp kim loại gồm Na và Cu cần vừa đủ 2,24 lít O2 (đktc) thu được hỗn hợp chất rắn A gồm Na2O và CuO. Hòa tan hoàn toàn A vào 200ml nước thu được dung dịch B và chất rắn không tan C.
a) Viết phương trình phản ứng và tính khối lượng mỗi chất ban đầu.
b) tính nồng độ mol/l và nồng độ phần trăm của chất tan có trong dung dịch B.( Coi thể tích dung dịch không thay đổi không đáng kể trong quá trình thí nghiệm, DH2O= 1g/ml)
Hòa tan hoàn toàn m gam hỗn hợp E gồm Sn và một kim loại R (có hóa trị không đổi) trong lượng dư dung dịch HCl, thu được 5,04 lít khí H2 (đktc) và dung dịch chứa 36,27 gam muối. Mặt khác, để đốt cháy cũng m gam hỗn hợp E cần vừa đủ 3,696 lít O2 (đktc). Kim loại R là A. Al B. Zn C. Ca C. Ca
Đọc tiếp
Hòa tan hoàn toàn m gam hỗn hợp E gồm Sn và một kim loại R (có hóa trị không đổi) trong lượng dư dung dịch HCl, thu được 5,04 lít khí H2 (đktc) và dung dịch chứa 36,27 gam muối. Mặt khác, để đốt cháy cũng m gam hỗn hợp E cần vừa đủ 3,696 lít O2 (đktc). Kim loại R là
A. Al
B. Zn
C. Ca
C. Ca
Gọi hóa trị của R là n và số mol Sn và R lần lượt là a và b mol
+/ Khi phản ứng với HCl :
Sn + HCl → SnCl2 + H2
R + nHCl → RCln + 0,5nH2
+/ Khi đốt trong oxi :
Sn + O2 → SnO2
2R + 0,5nO2 → R2On
=> Ta có : nH2 = a + 0,5nb = 0,225 mol
Và nO2 = a + 0,25nb = 0,165 mol
=> a = 0,105 mol ; nb = 0,24 mol
Có mmuối = 0,105.190 + 0,24/n . (R + 35,5n) = 36,27
=>R = 32,5n
=>Cặp n =2 ; R =65 (Zn) thỏa mãn
=>B
Đúng 0
Bình luận (0)
Đốt cháy hoàn toàn hỗn hợp gồm Al và Mg cần vừa đủ 1,12 lít khí O2 (đktc). Để hòa tan hết sản phẩm thu được cần ít nhất m gam dung dịch hỗn hợp gồm HCl 7,3% và H2SO4 9,8%. Giá trị của m là: A. 100. B. 50. C. 25. D. 75.
Đọc tiếp
Đốt cháy hoàn toàn hỗn hợp gồm Al và Mg cần vừa đủ 1,12 lít khí O2 (đktc). Để hòa tan hết sản phẩm thu được cần ít nhất m gam dung dịch hỗn hợp gồm HCl 7,3% và H2SO4 9,8%. Giá trị của m là:
A. 100.
B. 50.
C. 25.
D. 75.
Đốt cháy hoàn toàn hỗn hợp gồm Al và Mg cần vừa đủ 1,12 lít khí O2 (đktc). Để hòa tan hết sản phẩm thu được cần ít nhất m gam dung dịch hỗn hợp gồm HCl 7,3% và H2SO4 9,8%. Giá trị của m là:
A. 100.
B. 50.
C. 25.
D. 75.
Hỗn hợp X gồm Mg và Al. Hòa tan hoàn toàn 7,5 gam hỗn hợp X bằng lượng vừa đủ V lít dung dịch HNO3 1M, thu được 0,672 lít N2 ở đktc (là khí duy nhất thoát ra) và dung dịch chứa 54,9 gam muối. Giá trị của V là:
A. 0,65.
B. 0,72.
C. 0,70.
D. 0,86.
Đáp án D
Đặt nNH4NO3 = x ||⇒ ∑nNO3/muối KL = ne = (8x + 0,3) mol.
||⇒ mmuối = mKL + mNO3/muối KL + mNH4NO3 = 7,5 + 62 × (8x + 0,3) + 80x = 54,9(g).
⇒ x = 0,05 mol ⇒ nHNO3 = 10nNH4NO3 + 12nN2 = 0,86 mol ⇒ V = 0,86 lít
Đúng 0
Bình luận (0)