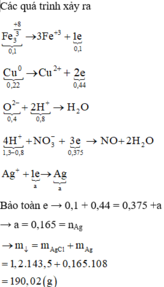Hòa tan hoàn toàn 19,2 gam Cu bằng dung dịch HNO3, toàn bộ lượng khí NO thu được đem oxi hóa thành NO2 rồi chuyển hết thành HNO3. Thể tích khí oxi(đktc) đã tham gia vào quá trình trên là bao nhiêu

Những câu hỏi liên quan
Hòa tan hoàn toàn m gam Fe3O4 vào dung dịch HNO3 loãng dư, tất cả lượng khí NO thu được được đem oxi hóa thành NO2 rồi sục vào nước cùng dòng khí O2 để chuyển hết thành HNO3. Cho biết thể tích oxi đã tham gia quá trình trên là 3,36 lít. Khối lượng m là: A. 139,2 B. 13,92 C. 1,392 D. 1392
Đọc tiếp
Hòa tan hoàn toàn m gam Fe3O4 vào dung dịch HNO3 loãng dư, tất cả lượng khí NO thu được được đem oxi hóa thành NO2 rồi sục vào nước cùng dòng khí O2 để chuyển hết thành HNO3. Cho biết thể tích oxi đã tham gia quá trình trên là 3,36 lít. Khối lượng m là:
A. 139,2
B. 13,92
C. 1,392
D. 1392
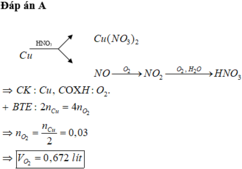
Đáp án A
Các phản ứng xảy ra:
3Fe3O4 + 28HNO3 g 9Fe(NO3)3 + NO + 14H2O
NO + O2 g NO2
2NO2 + O2 + H2O g2HNO3
Trong toàn bộ quá trình, chỉ có nguyên tố Fe và O thay đổi số oxi hóa (nguyên tố N không có sự thay đổi số oxi hóa). Do đó ta có các quá trình nhường và nhận electron như sau:

Đúng 0
Bình luận (0)
hòa tan hoàn toàn 19,2 gam Cu vào dung dịch HNO3 loãng. tất cả khí NO thu được đem đi oxy hóa thành NO2 rồi sục vào nước có mặt O2 để chuyển hết thành HNO3. thể tích O2 đã tham gia vào quá trình trên là?(mng giải ra đáp số hộ em nhé)
Cách giải bài này nhanh nhất là dùng bảo toàn e ch ,nhận là ra ngay ,,mà thích pt thì có ::
3Cu+8HNO3 → 3Cu(NO3)2 + 2NO +4 H20
NO+1/2 O2 → NO2
NO2 +1/2O2 +1/2 H2O→ HNO3 Theo pt tính đk Vo2= 0,1.22,4= 2,24 l
Đúng 0
Bình luận (0)
Cho 19,2 g Cu tác dụng hết với dung dịch
HNO
3
loãng, dư. Khí NO thu được đem oxi hoá thành
NO
2
rồi sục vào nước cùng với dòng khí
O
2
để chuyển hết thành
HNO
3
. Thể tích khí
O
2
(đktc) đã tham gia vào quá trình trên là A. 2,24 lít B. 3,36 lít C. 4,48 lít D. 6,72 lít
Đọc tiếp
Cho 19,2 g Cu tác dụng hết với dung dịch HNO 3 loãng, dư. Khí NO thu được đem oxi hoá thành NO 2 rồi sục vào nước cùng với dòng khí O 2 để chuyển hết thành HNO 3 . Thể tích khí O 2 (đktc) đã tham gia vào quá trình trên là
A. 2,24 lít
B. 3,36 lít
C. 4,48 lít
D. 6,72 lít
Hoà tan hoàn toàn 4,8 gam hỗn hợp gồm
F
e
S
2
và FeO vào 54 gam dung dịch
H
N
O
3
42%, thu được dung dịch X và 2,24 lít (đktc) hỗn hợp khí gồm NO và
N
O
2
. Biết rằng lưu huỳnh trong
F
e
S
2
chỉ bị oxi hóa thành
S
+...
Đọc tiếp
Hoà tan hoàn toàn 4,8 gam hỗn hợp gồm F e S 2 và FeO vào 54 gam dung dịch H N O 3 42%, thu được dung dịch X và 2,24 lít (đktc) hỗn hợp khí gồm NO và N O 2 . Biết rằng lưu huỳnh trong F e S 2 chỉ bị oxi hóa thành S + 6 . Cho dung dịch B a O H 2 dư vào X, lọc kết tủa rồi đem nung đến khối lượng không đổi thu được 9,46 gam chất rắn. Nếu cho Cu dư vào X thì lượng Cu bị hòa tan tối đa là
A. 4,8 gam
B. 3,2 gam
C. 6,4 gam
D. 1,6 gam
Hòa tan hoàn toàn 3,84 gam Cu trong dung dịch
H
N
O
3
dư, thu được khí NO (sản phẩm khử duy nhất). Trộn lượng NO trên với
O
2
dư, thu được hỗn hợp khí Y. Sục Y vào nước dư, thu được dung dịch Z và còn lại khí
O
2
duy nhất. Tổng thể tích
O
2
(đktc) đã phản ứng là A. 0,672 lít. B. 0,896 lít. C....
Đọc tiếp
Hòa tan hoàn toàn 3,84 gam Cu trong dung dịch H N O 3 dư, thu được khí NO (sản phẩm khử duy nhất). Trộn lượng NO trên với O 2 dư, thu được hỗn hợp khí Y. Sục Y vào nước dư, thu được dung dịch Z và còn lại khí O 2 duy nhất. Tổng thể tích O 2 (đktc) đã phản ứng là
A. 0,672 lít.
B. 0,896 lít.
C. 0,504 lít.
D. 0,784 lít.
Câu 4. Đốt cháy hoàn toàn 6,9 gam Natri thì cần V lít khí oxi đo ở (đktc).
a) Viết phương trình hóa học của phản ứng xảy ra
b) Tính thể tích của khí Oxi đã dùng
c) Toàn bộ sản phẩm đem hòa tan hết trong nước thì thu được 180g dung dịch A. Tính nồng độ phần trăm của dung dịch A.
Cho biết nguyên tử khối của các nguyên tố: (Cu = 64, O = 16, H = 1, Na = 23)
\(nNa=\dfrac{6,9}{23}=0,3\left(mol\right)\)
\(4Na+O_2\underrightarrow{t^o}2Na_2O\)
4 1 2 (mol)
0,3 0,075 0,15
\(VO_2=0,075.22,4=1,68\left(l\right)\)
\(Na_2O+H_2O\rightarrow2NaO H\)
1 1 2 (mol)
0,15 0,15 0,3 (mol)
\(m_{NaOH}=0,3.40=12\left(g\right)\)
\(C\%_{ddA}=\dfrac{12.100}{180}=6,67\%\)
Đúng 2
Bình luận (0)
Hòa tan hoàn toàn 3,84 gam Cu trong dung dịch HNO3 dư thu được khí NO (sản phẩm khử duy nhất). Trộn NO trên với O2 dư, thu được hỗn hợp khí Y. Sục Y vào nước dư, thu được dung dịch Z và còn lại khí O2 duy nhất. Tổng thể tích O2 (đktc) đã phản ứng là A. 0,896 lít B. 0,672 lít C. 0,504 lít C. 0,504 lít
Đọc tiếp
Hòa tan hoàn toàn 3,84 gam Cu trong dung dịch HNO3 dư thu được khí NO (sản phẩm khử duy nhất). Trộn NO trên với O2 dư, thu được hỗn hợp khí Y. Sục Y vào nước dư, thu được dung dịch Z và còn lại khí O2 duy nhất. Tổng thể tích O2 (đktc) đã phản ứng là
A. 0,896 lít
B. 0,672 lít
C. 0,504 lít
C. 0,504 lít
Hòa tan hết 37,28 gam hỗn hợp X gồm
F
e
3
O
4
, Cu trong 500 ml dung dịch chứa HCl 2,4M và
H
N
O
3
0,2M, thu được dung dịch Y và khí NO. Cho dung dịch NaOH dư vào dung dịch Y, lọc, lấy kết tủa nung trong không khí đến khối lượng không đổi được 41,6 gam chất rắn Z. Cho dung dịch
A
g
N
O
3...
Đọc tiếp
Hòa tan hết 37,28 gam hỗn hợp X gồm F e 3 O 4 , Cu trong 500 ml dung dịch chứa HCl 2,4M và H N O 3 0,2M, thu được dung dịch Y và khí NO. Cho dung dịch NaOH dư vào dung dịch Y, lọc, lấy kết tủa nung trong không khí đến khối lượng không đổi được 41,6 gam chất rắn Z. Cho dung dịch A g N O 3 dư vào dung dịch Y có khí NO thoát ra và thu được m gam kết tủa. Biết sản phẩm khử duy nhất của N O - 3 là NO, C l - không bị oxi hóa trong các quá trình phản ứng, các phản ứng hóa học xảy ra hoàn toàn. Giá trị của m là
![]()
![]()
![]()
![]()
Hòa tan hết 37,28 gam hỗn hợp X gồm Fe3O4, Cu trong 500 ml dung dịch chứa HCl 2,4M và HNO3 0,2M, thu được dung dịch Y và khí NO. Cho dung dịch NaOH dư vào dung dịch Y, lọc, lấy kết tủa nung trong không khí đến khối lượng không đổi được 41,6 gam chất rắn Z. Cho dung dịch AgNO3 dư vào dung dịch Y có khí NO thoát ra và thu được m gam kết tủa. Biết sản phẩm khử duy nhất là NO, Cl− không bị oxi hóa trong các quá trình phản ứng, các phản ứng hóa học xảy ra hoàn toàn. Giá trị của m là A. 204,6 ...
Đọc tiếp
Hòa tan hết 37,28 gam hỗn hợp X gồm Fe3O4, Cu trong 500 ml dung dịch chứa HCl 2,4M và HNO3 0,2M, thu được dung dịch Y và khí NO. Cho dung dịch NaOH dư vào dung dịch Y, lọc, lấy kết tủa nung trong không khí đến khối lượng không đổi được 41,6 gam chất rắn Z. Cho dung dịch AgNO3 dư vào dung dịch Y có khí NO thoát ra và thu được m gam kết tủa. Biết sản phẩm khử duy nhất là NO, Cl− không bị oxi hóa trong các quá trình phản ứng, các phản ứng hóa học xảy ra hoàn toàn. Giá trị của m là
A. 204,6
B. 172,2
C. 198,12
D. 190,02
Hòa tan hết 37,28 gam hỗn hợp X gồm Fe3O4, Cu trong 500 ml dung dịch chứa HCl 2,4M và HNO3 0,2M, thu được dung dịch Y và khí NO. Cho dung dịch NaOH dư vào dung dịch Y, lọc, lấy kết tủa nung trong không khí đến khối lượng không đổi được 41,6 gam chất rắn Z. Cho dung dịch AgNO3 dư vào dung dịch Y có khí NO thoát ra và thu được m gam kết tủa. Biết sản phẩm khử của NO3- là NO duy nhất, Cl- không bị oxi hóa trong các quá trình phản ứng, các phản ứng hóa học xảy ra hoàn toàn. Giá trị của m là A. 198,1...
Đọc tiếp
Hòa tan hết 37,28 gam hỗn hợp X gồm Fe3O4, Cu trong 500 ml dung dịch chứa HCl 2,4M và HNO3 0,2M, thu được dung dịch Y và khí NO. Cho dung dịch NaOH dư vào dung dịch Y, lọc, lấy kết tủa nung trong không khí đến khối lượng không đổi được 41,6 gam chất rắn Z. Cho dung dịch AgNO3 dư vào dung dịch Y có khí NO thoát ra và thu được m gam kết tủa. Biết sản phẩm khử của NO3- là NO duy nhất, Cl- không bị oxi hóa trong các quá trình phản ứng, các phản ứng hóa học xảy ra hoàn toàn. Giá trị của m là
A. 198,12.
B. 190,02.
C. 172,2.
D. 204,6.
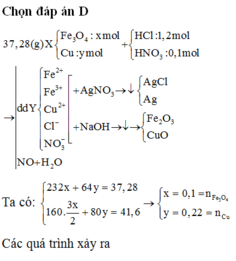
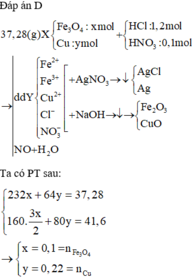
Đáp án B
Đặt nFe₃O₄ = x; nCu = y ⇒ mX = 232x + 64y = 37,28(g).
~ Chú ý: "hòa tan hết" ⇒ toàn bộ nguyên tố Fe và Cu sẽ đi hết vào oxit :P
Mặt khác, nung trong KHÔNG KHÍ
⇒ oxit là Fe₂O₃ (1,5x mol) và CuO (y mol).
⇒ m oxit = 41,6(g) = 160.1,5x + 80y
⇒ giải hệ có: x = 0,1 mol; y = 0,22 mol
► nHCl = 1,2 mol; nHNO₃ = 0,1 mol
⇒ nH⁺ = 1,3 mol; nNO₃⁻ = 0,1 mol.
Do Y + AgNO₃ -> sinh ra khí NO
⇒ Y có chứa H⁺, Fe²⁺ và không chứa NO₃⁻
(vì nếu có NO₃⁻ sẽ phản ứng sinh ra NO rồi :P)
Bỏ qua phần H⁺ "trung hòa" oxi trong oxit: 2H⁺ + O → H₂O thì còn
nH⁺ = 1,3 - 0,4 × 2 = 0,5 mol
● Xét toàn bộ các quá trình cho - nhận electron:
– Cho e: 3Fe⁺⁸/₃ → 3Fe⁺³ + e
Cu → Cu²⁺ + 2e
– Nhận e: 4H⁺ + NO₃⁻ + 3e → NO + 2H₂O
Ag⁺ + e → Ag
Do NO₃⁻ cả quá trình dư (vì AgNO₃ dư) nên:
⇒ bảo toàn electron cả quá trình:
nFe₃O₄ + 2nCu = ³/₄nH⁺ + nAg
⇒ nAg = 0,165 mol (nH⁺ đây là nH⁺ không tính phần "trung hòa" oxi trong oxit )
BTNT(Cl) ⇒ nAgCl = nHCl = 1,2 mol
⇒ m = 0,165 × 108 + 1,2 × 143,5 = 190,02(g)
Đúng 0
Bình luận (0)