Bài 9/ Tính thể tích nước cần thêm vào để pha loãng 450ml dd H2SO4 1,4M thành dd H2SO4 0,75M

Những câu hỏi liên quan
Có 100ml dung dịch H2SO4 98%, khối lượng riêng là 1,84 g/ml. Người ta muốn pha loãng thể tích H2SO4 trên thành dung dịch H2SO4 20%.
Tính thể tích nước cần dung để pha loãng.
Thể tích nước cần dùng để pha loãng.
Khối lượng của 100ml dung dịch axit 98%
100ml × 1,84 g/ml = 184g
Khối lượng H2SO4 nguyên chất trong 100ml dung dịch trên: 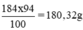
Khối lượng dung dịch axit 20% có chứa 180,32g H2SO4 nguyên chất: 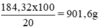
Khối lượng nước cần bổ sung vào 100ml dung dịch H2SO4 98% để có được dung dịch 20%: 901,6g – 184g = 717,6g
Vì D của nước là 1 g/ml nên thể tích nước cần bổ sung là 717,6 ml.
Đúng 1
Bình luận (0)
Tính thể tích dd H2SO4 98% (d = 1,83g/ml) cần dùng để pha đc 500ml dd H2SO4 0,1M. Nêu cáCh pha chế dd trên.
n H2SO4 = 0,5.0,1 = 0,05(mol)
m H2SO4 = 0,05.98 = 4,9(gam)
m dd H2SO4 = \(\dfrac{4,9}{98\%}\) = 5(gam)
V dd H2SO4 = \(\dfrac{5}{1,83}\) = 2,7322(cm3)
Đúng 2
Bình luận (1)
hòa tan hoàn toàn 0,56g sắt bằng dd H2SO4 loãng 19,6% vừa đủ
a) PTHH
b) Tính khối lượng muối tạo thành và thể tích khí H2 sinh ra
c) Cần bao nhiêu gam dd H2SO4 loãng nói trên để hòa tan sắt
Có 100 ml H2SO4 98% , khối lượng riêng là 1,84 g/ml. Nếu muốn pha loãng thể tích H2SO4 trên thành dung dịch H2SO4 20% thì cần thêm vào bao nhiêu ml nước? Bồ ơi giúp với❤
\(C\%_{sau}=0,2=\dfrac{100.1,84.0,98}{100.1,84+V_{H_2O}}\\ V_{H_2O}=717,6mL\)
Đúng 1
Bình luận (0)
trung hòa 100ml dd H2SO4 0,75M bằng dd KOH 25% . a)Tính thể tích dd KOH cần dùng. b) tính C% của dd muối sau phản ứng
cần bao nhiêu lít H2SO4(D=1,84g/ml) và bao nhiêu lit nước cất để pha thành 9 lit dd H2SO4 có D= 1,28g/ml
\(V_{H_2SO_4}=a\left(l\right),V_{H_2O}=b\left(l\right)\)
\(\Rightarrow a+b=9\left(1\right)\)
\(m_{dd_{H_2SO_4}}=1.84\cdot1000a+1000b=9000\cdot1.28\left(g\right)\left(2\right)\)
\(\left(1\right),\left(2\right):a=3,b=6\)
Đúng 4
Bình luận (0)
Bài1: Để trung hoà hết 600ml dd HNO3 1M cần V ml dd NaOH1M và Ba(OH)2 0,75M . Giá trị của V là Bài 2: DD A chứa H2SO4 0,01M và HCl 0,03M ; dd B chứa NaOH 0,05M và Ba(OH)2 0,015M . Thể tích ddA cần để trung hoà hết 200ml ddB là
Hòa tan m gam Fe bằng dd H2SO4 loãng(rất dư), thu được dd X. Để phản ứng hết dd X cần 100 ml dd KMnO4 0.3M tạo thành các sản phẩm Fe2(SO4)3, MnSO4, K2SO4 và nước. Tính tổng số mol H2SO4 cần cho phản ứng(Cho NTK Fe là 56).
Xem chi tiết
Fe + H2SO4 → FeSO4 + H2 (1)
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O(2)
nKMnO4 = 0,1.0,3 = 0,03 mol , nFeSO4 = 0,03.5 = 0,15 mol
=> nH2SO4 cần dùng cho (2) = 4 KMnO4 = 0,12 mol
nnH2SO4 cần dùng cho (1) = nFeSO4 = 0,15 mol
=> Tổng số mol H2SO4 cần dùng = 0,12 + 0,15 = 0,27 mol
Đúng 2
Bình luận (0)
hòa tan 0,56 g Fe vào dd H2SO4 loãng 19,6% phản ứng vừa đủ
a) tính khối lượng muối tạo thành và thể tích khí sinh ra (đktc)
b) tính khối lượng dd H2SO4đã dùng
c) tính C% dd muối tạo thành
a, \(n_{Fe}=\dfrac{0,56}{56}=0,01\left(mol\right)\)
PT: \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
Theo PT: \(n_{FeSO_4}=n_{H_2}=n_{Fe}=0,01\left(mol\right)\)
\(\Rightarrow m_{FeSO_4}=0,01.152=1,52\left(g\right)\)
\(V_{H_2}=0,01.22,4=0,224\left(l\right)\)
b, \(n_{H_2SO_4}=n_{Fe}=0,01\left(mol\right)\Rightarrow m_{ddH_2SO_4}=\dfrac{0,01.98}{19,6\%}=5\left(g\right)\)
c, Ta có: m dd sau pư = 0,56 + 5 - 0,01.2 = 5,54 (g)
\(\Rightarrow C\%_{FeSO_4}=\dfrac{1,52}{5,54}.100\%\approx27,44\%\)
Đúng 1
Bình luận (0)



















