tính phần trăm lưu huỳnh trong FES,Fes2,H2s04,H2S,So2
Hãy xác định số oxi hóa của các nguyên tố:
- Nitơ trong NO, NO2, N2O5, HNO3, HNO2, NH3, NH4Cl.
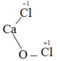
- Clo trong HCl, HClO, HClO2, HClO3, HClO4, CaOCl2.
- Mangan trong MnO2, KMnO4, K2MnO4, MnSO4.
- Crom trong K2Cr2O7, Cr2(SO4)3, Cr2O3.
- Lưu huỳnh trong H2S, SO2, H2SO3, H2SO4, FeS, FeS2.
- Đặt x là oxi hóa của nguyên tố nitơ trong các hợp chất trên, ta có:
Trong NO: x + (-2) = 0 → x = +2.
Trong NO2: x + 2.(-2) = 0 → x = +4.
Trong N2O5: 2x + 5.(-2) = 0 → x = +5.
Trong HNO3: (+1) + x + 3.(-2) = 0 → x = +5.
Trong HNO2: (+1) + x +2.(-2) = 0 → x = +3.
Trong NH3 : x + 3.(+1) = 0 → x = -3.
Trong NH4Cl: x + 4.(+1) +(-1) = 0 → x = -3.
- Cũng giải tương tự như trên ta có:
Số oxi hóa của Cl trong:
![]()
Số oxi hóa của Mn trong :
![]()
Số oxi hóa của Cr trong :
![]()
Số oxi hóa của S trong :
![]()
Trong công nghiệp, người ta thường sản xuất SO2 từ:
A. FeS, S B. FeS2, H2S C. S, FeS2 D. H2S, SO2
Hoàn thành giúp e chuỗi pt với
A)FeS2->SO2->S->FeS->H2S->S->SO2->H2SO4->HCl.
B) S->FeS->H2S->SO2->Na2SO3->Na2SO4->NaCl->HCl->SO2->S->FeS->H2S->S.
Xác địnhsố oxi hóacủa các nguyên tố sau:
a)Nitơ trongN2, NO, N2O, NO2, NH3, HNO3, NH4Cl, NO3, NH4.
b)Lưu huỳnh trong S, SO2, H2S, H2SO4, FeS2, SO24.
c)Cacbon trong CO2, H2CO3, CH4, Al4C3, CO.
d)Clo trong Cl2, HCl, Cl2, NaClO3, NaClO, HClO, HClO4.
e)Mangan trong MnO2, KMnO4, K2MnO4, MnSO4.
f)Crom trong K2Cr2O7, Cr2(SO4)3, Cr2O3, CrO3, Cr(OH)2, Na2CrO4.
g)Sắt trong FeO, Fe2O3, Fe(OH)3, Fe2(SO4)3, Fe3O4, FexOy, Fe3+
Cho các chất tham gia phản ứng:
a, S + F2
b, SO2 + H2S
c, SO2 + O2
d, S + H2SO4(đặc nóng)
e, H2S + Cl2 + H2O
f, FeS2 + HNO3
Khi các điều kiện (xúc tác, nhiệt độ) có đủ, số phản ứng tạo ra sản phẩm chứa lưu huỳnh ở mức số oxi hoá +6 là
A. 4
B. 3
C. 5
D. 2
Đáp án : A
Các phản ứng thỏa mãn : a , c , e , f
Cho các chất tham gia phản ứng:
(1): S+ F2
(2): SO2 + H2S
(3): SO2 + O2
(4): S+H2SO4(đặc,nóng)
(5): H2S + Cl2 (dư ) + H2O
(6): FeS2 + HNO3
Khi các điều kiện xúc tác và nhiệt độ có đủ, số phản ứng tạo ra sản phẩm mà lưu huỳnh ở mức số oxi hoá +6 là
A. 4.
B. 5.
C. 2.
D. 3.
Chọn đáp án A
Các phản ứng thỏa mãn : (1)(3) (5)(6)
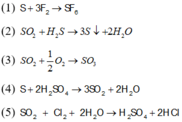
![]()
![]()
Dạng bài tập 4: Tính theo công thức hóa học
Câu 1: Tính phần trăm khối lượng của các nguyên tố trong hợp chất: NaNO3; K2CO3 , Al(OH)3, SO2, SO3, Fe2O3.
Câu 2: Một oxit của lưu huỳnh có thành phần trăm của lưu huỳnh là 50% và Oxi là 50%. Biết oxit này có khối lượng mol phân tử là 64 g/mol. Hãy tìm công thức hóa học của oxit
Câu 1 :
\(M_{K_2CO_3}=39.2+12+16.3=138\left(dvC\right)\)
\(\%K=\dfrac{39.2}{138}.100\%=56,52\%\)
\(\%C=\dfrac{12}{138}.100\%=8,69\%\)
\(\%O=100\%-56,52\%-8,69\%=34,79\%\)
Còn lại cậu làm tương tự nhá
Bài 2 :
\(M_S=\dfrac{64.50\%}{100\%}=32\left(g\right)\)
\(n_S=\dfrac{32}{32}=1\left(mol\right)\)
\(M_O=64-32=32\left(g\right)\\ n_O=\dfrac{32}{16}=2\left(mol\right)\)
\(=>CTHH:SO_2\)
Cho phản ứng: SO 2 + 2 H 2 S → 3 S + 2 H 2 O
Phát biểu nào sau đây đúng?
A. Lưu huỳnh bị oxi hoá và hiđro bị khử.
B. Lưu huỳnh bị khử và không có chất nào bị oxi hoá
C. Lưu huỳnh bị khử và hiđro bị oxi hoá
D. Lưu huỳnh trong SO 2 bị khử, lưu huỳnh trong H 2 S bị oxi hóa
Giúp với :
Hoàn thành pt phản ứng sau (ghi điều kiện nếu có):
a, FeS2--- > SO2--- > SO3--- > H2SO4 --- > SO2 --- >S--- >FeS--- > H2S--- > SO2.
b, H2S--- > S--- > H2S--- > SO2--- > BaSO3--- > SO2--- > H2SO4--- > BaSO4
c, H2S--- > SO2 < --- > SO3
S--- > SO2 --- > H2SO4
H2SO4--- > SO2 --- > S
d,. FeS--- > H2S (1) --- > S --- > SO2 --- > H2SO4
(1) --- > H2SO4 --- > CuSO4 --- > CuCl2
(1) --- > SO2 --- > HBr
a, 4FeS2+11O2--- > 8SO2+2Fe2O3
2SO2+O2--- > 2SO3
SO3+H2O--- > H2SO4
2H2SO4đ+Cu--- > SO2+CuSO4+2H2O
SO2+2H2S--- >3S+2H2O
S+Fe--- >FeS
FeS+2HCl--- > H2S+FeCl2
2H2S+3O2--- > 2SO2.+2H2O
b, 2H2S+SO2--- >3S+2H2O
S+H2--- > H2S
2H2S+3O2--- > 2SO2+2H2O
SO2+BaO--- > BaSO3
BaSO3+2HCl--- > SO2+BaCl2+H2O
2SO2+O2+2H2O-- > 2H2SO4
H2SO4+Ba--- > BaSO4+H2
c, 2H2S+3O2--- > 2SO2+2H2O
2SO2+O2--- > 2SO3
S+O2--- > SO2
SO3+H2O--- > H2SO4
2H2SO4đ+Cu--- > SO2+CuSO4+2H2O
SO2+2H2S--- > S+2H2O
d,. FeS+2HCl--- > H2S+FeCl2
(1)2H2S+SO2--- > 2S+2H2O
S+O2 --- > SO2
2SO2+O2-->2SO3
(1) SO3+H2O--- > H2SO4
H2SO4+CuO--- > CuSO4+H2O
CuSO4+BaCl2--- > CuCl2+BaSO4
(1) --- > SO2 --- > HBr