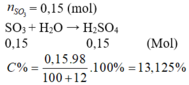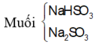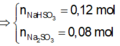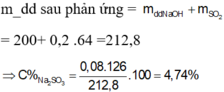Hấp thụ hoàn toàn 12 g SO3 vào 100 g H2O thu được dung dịch Y. Nồng độ phần trăm dung dịch Y = ?

Những câu hỏi liên quan
Đốt cháy hoàn toàn 2,24 lít H 2 S (đktc). Hấp thụ toàn bộ sản phẩm cháy vào 100 gam dung dịch NaOH 12% thu được dung dịch X. Nồng độ phần trăm của muối trong X là
A. 5,82%
B. 11,84%
C. 11,65%
D. 9,61%
Hấp thụ hoàn toàn 12 gam lưu huỳnh trioxit vào 100 gam nước. Nồng độ phần trăm của dung dịch thu được là (S 32, O 16, H 1) A. 12,00% B. 10,71% C. 13,13% D. 14,7%
Đọc tiếp
Hấp thụ hoàn toàn 12 gam lưu huỳnh trioxit vào 100 gam nước. Nồng độ phần trăm của dung dịch thu được là (S = 32, O = 16, H = 1)
A. 12,00%
B. 10,71%
C. 13,13%
D. 14,7%
Hấp thụ hoàn toàn V lít CO2 vào 400 ml dung dịch NaOH có nồng độ a mol/lit thì thu được dụng dịch X. Cho từ từ và khuấy đều 150 ml dung dịch HCl 1M vào X thu được dung dịch Y và 2,24 lít khí. Cho Y tác dụng với dung dịch Ca(OH)2 dư xuất hiện 15 gam kết tủa. Tính V và a, biết thể tích khí đo ở điều kiện tiêu chuẩn.
n(HCl) = 0,15 mol; n(CO2) = 0,1 mol.
+) Nếu NaOH dư thì dd X gồm Na2CO3 và NaOH.
BTNT(C): n(Na2CO3) = n(CO2) + n(CaCO3) = 0,1 + 0,15 = 0,25.
Để có khí thì lượng HCl phải lớn hơn số mol của NaOH và Na2CO3 cộng lại mà số mol HCl chỉ có 0,15 nên trường hợp này loại.
+) Vậy X gồm Na2CO3, NaHCO3.
Na2CO3 + HCl → NaHCO3 + NaCl. (1)
NaHCO3 + HCl → NaCl + CO2 + H2O. (2)
Nên n(Na2CO3) = n(HCl) – n(CO2) = 0,15 – 0,1 = 0,05.
BTNT (C): n(NaHCO3) = n(CO2) + n(CaCO3) – n(Na2CO3) = 0,1 + 0,15 – 0,05 = 0,2 mol.
BTĐT: n(OH) = 2.n(Na2CO3) + n(NaHCO3) = 2.0,05 + 0,2 = 0,3.
CM =a = 0,75M.
+) Bảo toàn C => \(n_{CO_2}=0,25\left(mol\right)\)
=>\(V=0,25.22,4=5,6\left(l\right)\)
Đúng 3
Bình luận (1)
CTV hay các thành viên cho em hỏi cái này của trương trình lớp 9 có phải ko ạ
Đúng 0
Bình luận (1)
Xem thêm câu trả lời
Hấp thụ hoàn toàn 5,32 lít khí CO2 (đktc) vào 100ml dung dịch NaOH 3,5625M thu được dung dịch Y. Tính nồng độ muối tan trong dd Y.
\(n_{CO_2}=\dfrac{5,32}{22,4}=0,2375\left(mol\right);n_{NaOH}=3,5625.0,1=0,35625\left(mol\right)\\ Vì:2>\dfrac{n_{NaOH}}{n_{CO_2}}=\dfrac{0,35625}{0,2375}=1,5>1\)
=> SP có 2 muối với tỉ lệ số mol bằng nhau, và mỗi muối có số mol bằng một nửa số mol CO2
\(\Rightarrow n_{Na_2CO_3}=n_{NaHCO_3}=\dfrac{n_{NaOH}}{2}=\dfrac{0,2375}{2}=0,11875\left(mol\right)\\ V_{ddY}=V_{ddNaOH}=0,1\left(l\right)\\ C_{MddNa_2CO_3}=C_{MddNaHCO_3}=\dfrac{0,11875}{0,1}=1,1875\left(M\right)\)
Đúng 1
Bình luận (0)
Hấp thụ hoàn toàn 5,6 lít CO2 vào dung dịch 85,5 gam dung dịch Ba(OH)2. Sau phản ứng lọc tách kết tủa thu được dung dịch có khối lượng 39,95 gam. Tính nồng độ phần trăm của dung dịch Ba(OH)2
Hấp thụ hoàn toàn 3,92 lít khí CO2 (đktc) vào 100ml dung dịch KOH 2,15M thu được dung dịch X. Tính nồng độ muối tan trong dd X. Tính phần trăm theo khối lượng từng muối trong
dung dịch X
\(n_{CO_2}=\dfrac{3,92}{22,4}=0,175\left(mol\right)\)
\(n_{KOH}=0,1.2,15=0,215\left(mol\right)\)
\(\Rightarrow\dfrac{n_{KOH}}{n_{CO_2}}=1,23\) → Pư tạo KHCO3 và K2CO3
PT: \(CO_2+2KOH\rightarrow K_2CO_3+H_2O\)
\(CO_2+KOH\rightarrow KHCO_3\)
Ta có: \(\left\{{}\begin{matrix}n_{CO_2}=n_{K_2CO_3}+n_{KHCO_3}=0,175\\n_{KOH}=2n_{K_2CO_3}+n_{KHCO_3}=0,215\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}n_{K_2CO_3}=0,04\left(mol\right)\\n_{KHCO_3}=0,135\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}C_{M_{K_2CO_3}}=\dfrac{0,04}{0,1}=0,4\left(M\right)\\C_{M_{KHCO_3}}=\dfrac{0,135}{0,1}=1,35\left(M\right)\end{matrix}\right.\)
\(\%m_{K_2CO_3}=\dfrac{0,04.138}{0,04.138+0,135.100}.100\%\approx29,02\%\)
\(\%m_{KHCO_3}=70,98\%\)
Đúng 1
Bình luận (0)
Bài 7: Hòa tan hết 12,4 gam Na2O vào nước, thu được 200 gam dung dịch X. a) Tính nồng độ phần trăm của dung dịch X. b) Hấp thụ toàn bộ V lít khí SO2 (ở 25oC và 1 bar) vào lượng dung dịch X ở trên, thu được dung dịch Y chỉ chứa muối trung hòa. - Tính giá trị của V. - Tính nồng độ phần trăm của dung dịch Y.
Đốt cháy hoàn toàn 6,8 gam khí H2S thu được V lit SO2 (đktc) và m gam hơi nước. Hấp thụ toàn bộ SO2 ở trên vào 200 gam dung dịch NaOH 5,6% thì thu được dung dịchY. Nồng độ phần trăm của chất tan có phân tử khối lớn hơn trong Y là: A. 5,04% B. 4,74%. C. 6,24%. D. 5,86%
Đọc tiếp
Đốt cháy hoàn toàn 6,8 gam khí H2S thu được V lit SO2 (đktc) và m gam hơi nước. Hấp thụ toàn bộ SO2 ở trên vào 200 gam dung dịch NaOH 5,6% thì thu được dung dịchY. Nồng độ phần trăm của chất tan có phân tử khối lớn hơn trong Y là:
A. 5,04%
B. 4,74%.
C. 6,24%.
D. 5,86%
Bài 7: Hấp thụ hoàn toàn 3,36 lít CO2 (đktc) vào trong 200ml dung dịch NaOH 1M (khối lượng riêng D 1,25 g/ml) sau phản ứng thu được dung dịch X. Biết rằng khí CO2 tham gia được phản ứng sau: CO2 +H2O + muối trung hòa --- muối axit. Tính nồng độ phần trăm của chất tan trong dung dịch X.
Bài 8: Hòa tan muối RCO3 trong lượng vừa đủ dung dịch HNO3 20% thu được dung dịch có nồng độ muối là 26,582%. Tìm CTHH của muối cacbonat đã dùng.
Giúp mình vs
Đọc tiếp
Bài 7: Hấp thụ hoàn toàn 3,36 lít CO2 (đktc) vào trong 200ml dung dịch NaOH 1M (khối lượng riêng D = 1,25 g/ml) sau phản ứng thu được dung dịch X. Biết rằng khí CO2 tham gia được phản ứng sau: CO2 +H2O + muối trung hòa ---> muối axit. Tính nồng độ phần trăm của chất tan trong dung dịch X. Bài 8: Hòa tan muối RCO3 trong lượng vừa đủ dung dịch HNO3 20% thu được dung dịch có nồng độ muối là 26,582%. Tìm CTHH của muối cacbonat đã dùng. Giúp mình vs
Bài 7:
Ta có: \(\left\{{}\begin{matrix}n_{CO_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\\n_{NaOH}=0,2\cdot1=0,2\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\) Tạo 2 muối
PTHH: \(CO_2+2NaOH\rightarrow Na_2CO_3+H_2O\)
a_______2a__________a (mol)
\(CO_2+NaOH\rightarrow NaHCO_3\)
b_______b__________b (mol)
Ta lập HPT: \(\left\{{}\begin{matrix}a+b=0,15\\2a+b=0,2\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}a=0,05\\b=0,1\end{matrix}\right.\)
Mặt khác: \(m_{dd}=m_{CO_2}+m_{ddNaOH}=0,15\cdot44+200\cdot1,25=256,6\left(g\right)\)
\(\Rightarrow\left\{{}\begin{matrix}C\%_{Na_2CO_3}=\dfrac{0,05\cdot106}{256,6}\cdot100\%\approx2,1\%\\C\%_{NaHCO_3}=\dfrac{0,1\cdot72}{256,6}\cdot100\%\approx2,8\%\end{matrix}\right.\)
Đúng 2
Bình luận (0)
Bài 8:
PTHH: \(RCO_3+2HNO_3\rightarrow R\left(NO_3\right)_2+CO_2\uparrow+H_2O\)
Giả sử \(n_{RCO_3}=1\left(mol\right)\) \(\Rightarrow\left\{{}\begin{matrix}n_{HNO_3}=2\left(mol\right)\\n_{R\left(NO_3\right)_2}=1\left(mol\right)=n_{CO_2}\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{ddHNO_3}=\dfrac{2\cdot63}{20\%}=630\left(g\right)\\m_{R\left(NO_3\right)_2}=R+124\left(g\right)\\m_{CO_2}=44\left(g\right)\end{matrix}\right.\) \(\Rightarrow C\%_{R\left(NO_3\right)_2}=\dfrac{124+R}{R+60+630-44}=0,26582\)
\(\Leftrightarrow R=65\) (Kẽm) \(\Rightarrow\) CTHH của muối cacbonat là ZnCO3
Đúng 2
Bình luận (0)