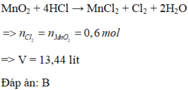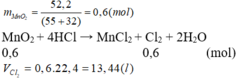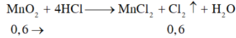Cho 17,4 g MnO2 phản ứng với 7,1 gam HCl thì thu được 1,008 l khí Cl2 đktc. Tính hiệu suất phản ứng

Những câu hỏi liên quan
Cho 17,4g MnO2 phản ứng với 250ml dd HCl 4M; thu được 3,584 lít Cl2 (đktc). Hiệu suất của phản ứng điều chế Cl2 là ?
\(PTHH:MnO_2+4HCl\rightarrow MnCl_2+2H_2O+Cl_2\)
Đổi 250ml = 0,25l
\(n_{HCl}=4.0,25=1\left(mol\right)\)
\(n_{MnO2}=\frac{17,4}{87}=0,2\left(mol\right)\)
Tỉ lê: \(n_{MnO2}< n_{HCl}\)
Nên MnO2 hết, HCl dư ( Tính nCl2 (lý thuyết) theo nMnO2 )
Số mol MnO2: số mol Cl2= 1:1
\(n_{Cl2}=n_{MnO2}=0,2\left(mol\right)\)
\(m_{Cl2\left(lt\right)}=0,2.71=14,2\left(g\right)\)
\(n_{Cl2\left(tt\right)}=\frac{3,584}{22,4}=0,16\left(mol\right)\)
\(\Rightarrow m_{Cl2\left(tt\right)}=0,16.71=1,36\left(g\right)\)
\(\Rightarrow H=\frac{11,36}{14,2}.100\%=80\%\)
Tính hiệu suất của phản ứng điều chế khí clo khi cho 17,4g Mno2 tác dụng với Hcl đặc dư thì thu được 3,584 lít khí clo (đktc).giúp mình với
\(n_{MnO_2}=\dfrac{17,4}{87}=0,2\left(mol\right)\\ PTHH:MnO_2+4HCl_{đặc,nóng}\rightarrow MnCl_2+Cl_2+2H_2O\\ n_{Cl_2\left(TT\right)}=\dfrac{3,584}{22,4}=0,16\left(mol\right)\\ n_{Cl_2\left(LT\right)}=n_{MnO_2}=0,2\left(mol\right)\\ \Rightarrow H=\dfrac{n_{Cl_2\left(TT\right)}}{n_{Cl_2\left(LT\right)}}.100\%=\dfrac{0,16}{0,2}.100=80\%\)
Đúng 2
Bình luận (0)
Cho 8,7 gam MnO2 tác dụng với dung dịch axit HCl đậm đặc sinh ra V lít khí Cl2 (đktc). Hiệu suất phản ứng là 85%. V có giá trị là:
A. 2 lít
B. 2,905 lít
C. 1,904 lít
D. 1,82 lít
Cho 8,7 gam MnO2 tác dụng với dung dịch axit HCl đậm đặc sinh ra V lít khí Cl2 (đktc). Hiệu suất phản ứng là 85%. V có giá trị là :
A. 2 lít
B. 2,905 lít
C. 1,904 lít
D. 1,82 lít
Đáp án C
![]()
MnO2 + 4HCl →MnCl2 + 2H2O + Cl2
0,1 →0,1 (mol)
Do H% = 85% => ![]() = 0,085 (mol)
= 0,085 (mol)
V = 0,085.22,4 = 1,904 (lít)
Đúng 0
Bình luận (0)
Cho 17,4 gam MnO2 tác dụng với axit HCl dư. Sau phản ứng thu được 3,8 lít khí clo (đktc). Hiệu suất của phản ứng là bao nhiêu ?
\(4HCl+MnO2-->Cl2+2H2O+MnCl2\)
\(n_{MnO2}=\frac{17,4}{87}=0,2\left(mol\right)\)
\(n_{Cl2}=n_{MnO2}=0,2\left(mol\right)\)
\(V_{Cl2}=0,2.22,4=4,48\left(l\right)\)
\(H\%=\frac{3,8}{4,48}.100\%=84,82\%\)
nCl2=3,8\22,4=0,17 mol
nMnO2=17,4\87=0,2 mol
=>MnO2+4HCl-->MnCl2+Cl2+H2O
....0,2-----------------------0,2 mol
=>H=0,17\0,2.100=85 %
Hòa tan hoàn toàn 52,2 gam MnO 2 trong dung dịch HCl đặc, nóng, dư thì sau phản ứng thu được bao nhiêu lít khí Cl 2 (đktc)?
A. 6,72 lít
B. 13,44 lít
C. 14,56 lít
D. 19,2 lít
Hòa tan hoàn toàn 52,2 gam MnO2 trong dung dịch HCl đặc, nóng, dư thì sau phản ứng thu được bao nhiêu lít khí Cl2 ở đktc?
A. 11,2
B. 13,44
C. 8,96
D. 6,72
Hòa tan hoàn toàn 52,2 gam MnO2 trong dung dịch HCl đặc, nóng, dư thì sau phản ứng thu được bao nhiêu lít khí Cl2 ở đktc?
A. 11,2
B. 13,44
C. 8,96
D. 6,72.
1) Cho 39,15 gam MnO2 tác dụng với dd HCl đặc, khí sinh ra cho tác dụng với một lượng sắt dư thì thu được bao nhiêu gam muối. Biết hiệu suất của cả quá trình là 86%.
2) để điều chế được đủ lượng khí Clo tác dụng vừa đủ với 14,4 gam Mg thì người ta cần dùng bao nhiêu gam KMnO4. Biết hiệu suất phản ứng điều chế cho Clo là 80%.
3) Người ta có thể điều chế được bao nhiêu lít khi Clo (đktc) từ 63,2 gam KMnO4. Biết hiệu suất phản ứng là 75%.
4) Cho 13,05 gam MnO2 tác dụng với dd HCl đặc dư thì thu...
Đọc tiếp
1) Cho 39,15 gam MnO2 tác dụng với dd HCl đặc, khí sinh ra cho tác dụng với một lượng sắt dư thì thu được bao nhiêu gam muối. Biết hiệu suất của cả quá trình là 86%.
2) để điều chế được đủ lượng khí Clo tác dụng vừa đủ với 14,4 gam Mg thì người ta cần dùng bao nhiêu gam KMnO4. Biết hiệu suất phản ứng điều chế cho Clo là 80%.
3) Người ta có thể điều chế được bao nhiêu lít khi Clo (đktc) từ 63,2 gam KMnO4. Biết hiệu suất phản ứng là 75%.
4) Cho 13,05 gam MnO2 tác dụng với dd HCl đặc dư thì thu được 8,52 gam khí Clo. Tính hiệu suất cảu phản ứng.
5) Đun nóng 6,125 gam KClO3 với HCl đặc. Biết hiệu suất phản ứng là 85%. Thể tích Cl2 thu được ở ĐKTC là bao nhiêu.
6) Có 12 litts hỗn hợp 2 khí Cl2 và H2 đựng trong bình thạch anh đậy kín. Chiếu sáng để phản ứng sảy ra thì thu được một hỗn hợp khí chứa 30% thể tích là khí sản phẩm, lượng Cl2 còn lại 20% so với ban đầu (các thể tích khí đo ở cùng nhiệt độ và áp suất)
a) Tính % thể tích của hỗn hợp trước và sau phản ứng.
b) Tính hiệu suất phản ứng.
MnO\(_2\)+4HCl\(\rightarrow\)MnCl\(_2\)+Cl\(_2\)+2H\(_2O\)
0,45 0,45 (mol)
n\(_{MnO_2}\)=\(\dfrac{39,15}{87}\)=0,45(mol)
2Fe + 3Cl\(_2\)\(\rightarrow\)2FeCl\(_3\)
0,3 0,45 0,3 (mol)
m\(_{FeCl_3}\)=0,3.162,5=48,75(g)
vì hiệu suất phản ứng là 86% nên:
m\(_{FeCl_3}\)=\(\dfrac{86.48,75}{100}\)=41,925(g)
Đúng 0
Bình luận (0)
2/
Mg+Cl\(_2\)\(\rightarrow\)MnCl\(_2\)
0,6 0,6
n\(_{Mg}\)=\(\dfrac{14,4}{24}\)=0,6(mol)
2\(KMnO_4+16HCl\rightarrow2MnCl_2+2KCl+5Cl_2\uparrow+8H_2O\)
0,24 0,6
vì hiệu suất phản ứng bằng 80%,nên để điều chế 0,6 mol Cl\(_2\)thì cần số mol \(KMnO_4\) là:
n\(_{KMnO_4}\)=\(\dfrac{0,24.100}{80}\)=0,3(mol)
m\(KMnO_4\)=0,3.158=47,4(g)
Đúng 0
Bình luận (0)
3/
2KMnO4+16HCl→2MnCl2+2KCl+5Cl2↑+8H2O
0,4 1 (mol)
n\(_{KMnO_4}\)=\(\dfrac{63,2}{158}\)=0,4(mol)
V\(_{Cl_2}\)=1.22,4=22,4(l)
vì Hiệu suất phản ứng là 75% nên:
V\(_{Cl_2}\)=\(\dfrac{75.22,4}{100}\)=16,8(l)
Đúng 0
Bình luận (0)
Xem thêm câu trả lời