3.Khử 4,8 gam đồng(II) oxit ( CuO) bằng khí hiđro
a.Tính số gam đồng kim loại kim loại thu được?
b.Tính thể tích khí hiđro ( ĐKTC ) đã dùng.
Khử 48 gam đồng(II) oxit bằng khí hiđro. Hãy:
a) Tính số gam đồng kim loại thu được.
b) Tính thể tích khí hiđro (đktc) cần dùng.
nCuO = 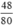 = 0,6 mol.
= 0,6 mol.
Phương trình hóa học của phản ứng khử CuO:
CuO + H2 → Cu + H2O.
nCu = 0,6mol.
mCu = 0,6 .64 = 38,4g.
Theo phương trình phản ứng trên:
nH2 = 0,6 mol
VH2 = 0,6 .22,4 = 13,44 lít.
khử 9,6 gam đồng (ll) oxit bằng khí hiđro. hãy:
a)tính số gam đồng kim loại thu được;
b)tính thể tích khí hiđro (đktc)cần dùng.
\(n_{CuO}=\dfrac{9,6}{80}=0,12mol\)
\(CuO+H_2\rightarrow Cu+H_2O\)
0,12 0,12 0,12
a)\(m_{Cu}=0,12\cdot64=7,68g\)
b)\(V=0,12\cdot22,4=2,688l\)
\(n_{CuO}=\dfrac{m_{CuO}}{M_{CuO}}=\dfrac{9,6}{80}=0,12mol\)
\(CuO+H_2\rightarrow\left(t^o\right)Cu+H_2O\)
0,12 0,12 0,12 ( mol )
\(m_{Cu}=n_{Cu}.M_{Cu}=0,12.56=6,72g\)
\(V_{H_2}=n_{H_2}.22,4=0,12.22,4=2,688l\)
Bài 6: Khử 48 gam đồng (II) oxit bằng khí hidro. Hãy:
a) Tính số gam đồng kim loại thu được
Tính thể tích khí hiđro (đktc) cần dùng
nCuO = 48 : 80 = 0,6 (Mol)
pthh : CuO + H2 -t--> Cu + H2O
0,6---->06------>0,6
=> mCu= 0,6 . 64 = 38,4 (G)
=> VH2 = 0,6 .22,4 = 13,44 (L)
a, \(n_{CuO}=\dfrac{48}{80}=0,6\left(mol\right)\)
PTHH: CuO + H2 --to--> Cu + H2O
0,6 0,6 0,6
\(\rightarrow\left\{{}\begin{matrix}m_{Cu}=0,6.64=38,4\left(g\right)\\V_{H_2}=0,6.22,4=13,44\left(l\right)\end{matrix}\right.\)
PTHH : \(CuO+H_2\left(t^o\right)->Cu+H_2O\) (1)
a) \(n_{CuO}=\dfrac{m}{M}=\dfrac{48}{64+16}=0,6\left(mol\right)\)
Từ (1) -> \(n_{Cu}=n_{CuO}=n_{H_2}=0,6\left(mol\right)\)
-> \(m_{Cu}=n.M=0,6.64=38,4\left(g\right)\)
\(V_{H_2}=n.22,4=0,6.22,4=13,44\left(l\right)\)
1/ khử 48 gam đồng (II) Oxit bằng khí hiđro.hãy
tính số gam đồng kim loại thu được
tính thể tích khí hiđro (đktc) cần dùng
2/ tính số gam nước thu được khi cho 8,4 lít khí hiđro tác dụng với 2,8 lít khí oxi (các thể tích khí đo ở đktc)
1/ \(CuO+H_2-^{t^o}\rightarrow Cu+H_2O\)
\(n_{Cu}=n_{CuO}=\dfrac{48}{80}=0,6\left(mol\right)\)
=> \(m_{Cu}=0,6.64=38,4\left(g\right)\)
\(n_{H_2}=n_{CuO}=0,6\left(mol\right)\)
=> \(V_{H_2}=0,6.22,4=13,44\left(l\right)\)
2. \(2H_2+O_2-^{t^o}\rightarrow2H_2O\)
\(n_{H_2}=0,375;n_{O_2}=0,125\)
Lập tỉ lệ \(\dfrac{0,375}{2}>\dfrac{0,125}{1}\)
=> Sau phản ứng H2 dư, tính theo số mol O2
\(n_{H_2O}=2n_{O_2}=0,25\left(mol\right)\)
=> \(m_{H_2O}=0,25.18=4,5\left(g\right)\)
Cho 4,8 gam kim loại magie tác dụng hoàn toàn với dung dịch axit HCl. Tính: a. Thể tích hiđro thu được ở đktc? c. Nếu dùng lượng khí Hiđro trên để khử vừa đủ một lượng oxit kim loại R hóa trị II thì thu được 12,8gam kim loại. Tìm kim loại R.
Mg+2HCl->MgCl2+H2
0,2-----------------------0,2
RO+H2-to>R+H2O
0,2-------------0,2
n Mg=\(\dfrac{4,8}{24}\)=0,2 mol
=>VH2=0,2.22,4=4,48l
->0,2=\(\dfrac{12,8}{R}\)
=>R=64 g\mol
=>R là Cu(đồng)
Khử 0,8g đồng (II) oxit bằng khí hiđro. (Cho Cu = 64; H = 1; O = 16; Cl = 35,5).Hãy: a/Tính số gam đồng kim loại thu được? b/Tính thể tích khí hiđro (đktc) cần dùng? c/Để có lượng H2 đó phải lấy bao nhiêu gam Fe cho tác dụng vừa đủ với bao nhiêu gam dd axit HCl 20
`n_[CuO]=[0,8]/80=0,01(mol)`
`H_2 + CuO` $\xrightarrow{t^o}$ `Cu + H_2 O`
`0,01` `0,01` `0,01` `(mol)`
`a)m_[Cu]=0,01.64=0,64(g)`
`b)V_[H_2]=0,01.22,4=0,224(l)`
`c)`
`Fe + 2HCl -> FeCl_2 + H_2`
`0,01` `0,02` `0,01` `(mol)`
`@m_[Fe]=0,01.56=0,56(g)`
`@m_[dd HCl]=[0,02.36,5]/20 . 100=3,65(g)`
Bài tập 5: Khử 8,1 gam kẽm oxit bằng khí hiđro.
a.Tính số gam kẽm thu được sau phản ứng.
b.Tính thể tích khí hiđro ( ĐKTC) cần dùng.
a) nZnO=8,1/81=0,1
BTNT nZn=0,1.65=6,5 (giả sử là phản ứng hoàn toàn)
b) ZnO + H2 = Zn + H2O
nH2= nZnO=0,1 --> V = 2,24l
Đốt cháy hoàn toàn kim loại đồng trong không khí, sau phản ứng thu được 16g đồng (II) oxit A) Tính khối lượng của kim loại đồng đã phản ứng B) Tính thể tích không khí cần dùng (oxi chiếm 20% thể tích không khí) C) Dùng 3,36 lít hiđro (đktc) để khử lượng đồng (II) oxit nói trên đến phản ứng hoàn toàn thu được chất rắn A. Tính khối lượng chất rắng A
a) \(n_{CuO}=\dfrac{16}{80}=0,2\left(mol\right)\)
PTHHL 2Cu + O2 --to--> 2CuO
0,2<--0,1<-------0,2
=> mCu = 0,2.64 = 12,8 (g)
b) \(V_{O_2}=0,1.22,4=2,24\left(l\right)\)
=> Vkk = 2,24 : 20% = 11,2 (l)
c) \(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
PTHH: CuO + H2 --to--> Cu + H2O
Xét tỉ lệ: \(\dfrac{0,2}{1}>\dfrac{0,15}{1}\) => CuO dư, H2 hết
PTHH: CuO + H2 --to--> Cu + H2O
0,15<-0,15----->0,15
=> \(\left\{{}\begin{matrix}n_{Cu}=0,15\left(mol\right)\\n_{CuO\left(dư\right)}=0,05\left(mol\right)\end{matrix}\right.\)
=> mA = 0,15.64 + 0,05.80 = 13,6 (g)
Bài làm:
Số mol đồng oxit (CuO) là:
$n_{CuO}$ = $\frac{m_{CuO}}{M_{CuO}}$ = $\frac{16}{80}$ = 0,2 (mol)
PTHH: 2Cu + $O_{2}$ --$t^{o}$--> 2CuO
Theo PT: 2 mol 1 mol <-- 2 mol
Theo bài: 0,2 mol 0,1 mol <-- 0,2 mol
a)Khối lượng đồng (Cu) là:
$m_{Cu}$ = $M_{Cu}$ . $n_{Cu}$ = 64. 0,2 = 12,8 (g)
b)Thế tích khí oxi ($O_{2}$) là:
$V_{O_{2}}$ = $n_{O_{2}}$ . 22,4 = 0,1 . 22,4 = 2,24 (lít)
Thể tích chiếm 20% thể tích không khí
=>$V_{kk}$ = 22,4 : 20% = 11,2 (lít)
c)Số mol khí hiđro ($H_{2}$) là:
$n_{H_{2}}$ = $\frac{m_{H_{2}}}{M_{H_{2}}}$ = $\frac{3,36}{22,4}$ = 0,15 (mol)
PTHH: CuO + H2 --to--> Cu + H2O
Theo PT: 1 mol 1 mol 1 mol 1 mol
Theo bài: 0,15 mol 0,15 mol 0,15 mol 0,15 mol
Xét tỉ lệ: $\frac{0,2}{1}$ > $\frac{0,15}{1}$
=> CuO dư, H2 hết
PTHH: CuO + H2 --to--> Cu + H2O
Theo PT: 1 mol 1 mol 1 mol 1 mol
Theo bài: 0,15 mol 0,15 mol 0,15 mol 0,15 mol
Số mol đồng (Cu) là: 0,15 mol như PTHH
Số mol đồng (II) oxit (CuO) dư là: 0,05 mol tự tính
=> mA = 0,15.64 + 0,05.80 = 13,6 (g)
ok chưa nè
#Aria_Cortez
Cho 5,4 gam kim loại nhôm tác dụng hoàn toàn với dung dịch axit clohiđric (HCl). Tính: a. Thể tích hiđro thu được ở đktc? b. Nếu dùng lượng khí Hiđro trên để khử vừa đủ một lượng oxit kim loại X hóa trị II thì thu được 19,5 gam kim loại. Tìm kim loại X.
2Al+3H2SO4->Al2(SO4)3+3H2
0,2-----------------------------------0,3
n Al=0,2 mol
=>VH2=0,3.22,4=6,72l
b)
XO+H2-to>X+H2O
0,3-------------0,3
=>0,3=\(\dfrac{19,5}{X}\)
=>X là Zn( kẽm)
a.\(n_{Al}=\dfrac{5,4}{27}=0,2mol\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
0,2 0,3 ( mol )
\(V_{H_2}=0,3.22,4=6,72l\)
b.\(n_X=\dfrac{19,5}{M_X}\)
\(XO+H_2\rightarrow\left(t^o\right)X+H_2O\)
\(\dfrac{19,5}{M_X}\) \(\dfrac{19,5}{M_X}\) ( mol )
Ta có:
\(\dfrac{19,5}{M_X}=0,3\)
\(\Leftrightarrow M_X=65\)
=> X là kẽm (Zn)
\(a,n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\\ PTHH:2Al+6HCl\rightarrow AlCl_3+3H_2\uparrow\\ Theo.pt:n_{H_2}=\dfrac{3}{2}n_{Al}=\dfrac{3}{2}.0,2=0,3\left(mol\right)\\ V_{H_2}=0,3.22,4=6,72\left(l\right)\\ b,PTHH:RO+H_2\underrightarrow{t^o}R+H_2O\\ Mol:0,3\leftarrow0,3\rightarrow0,3\\ M_R=\dfrac{19,5}{0,3}=65\left(\dfrac{g}{mol}\right)\\ \Rightarrow R.là.Zn\)