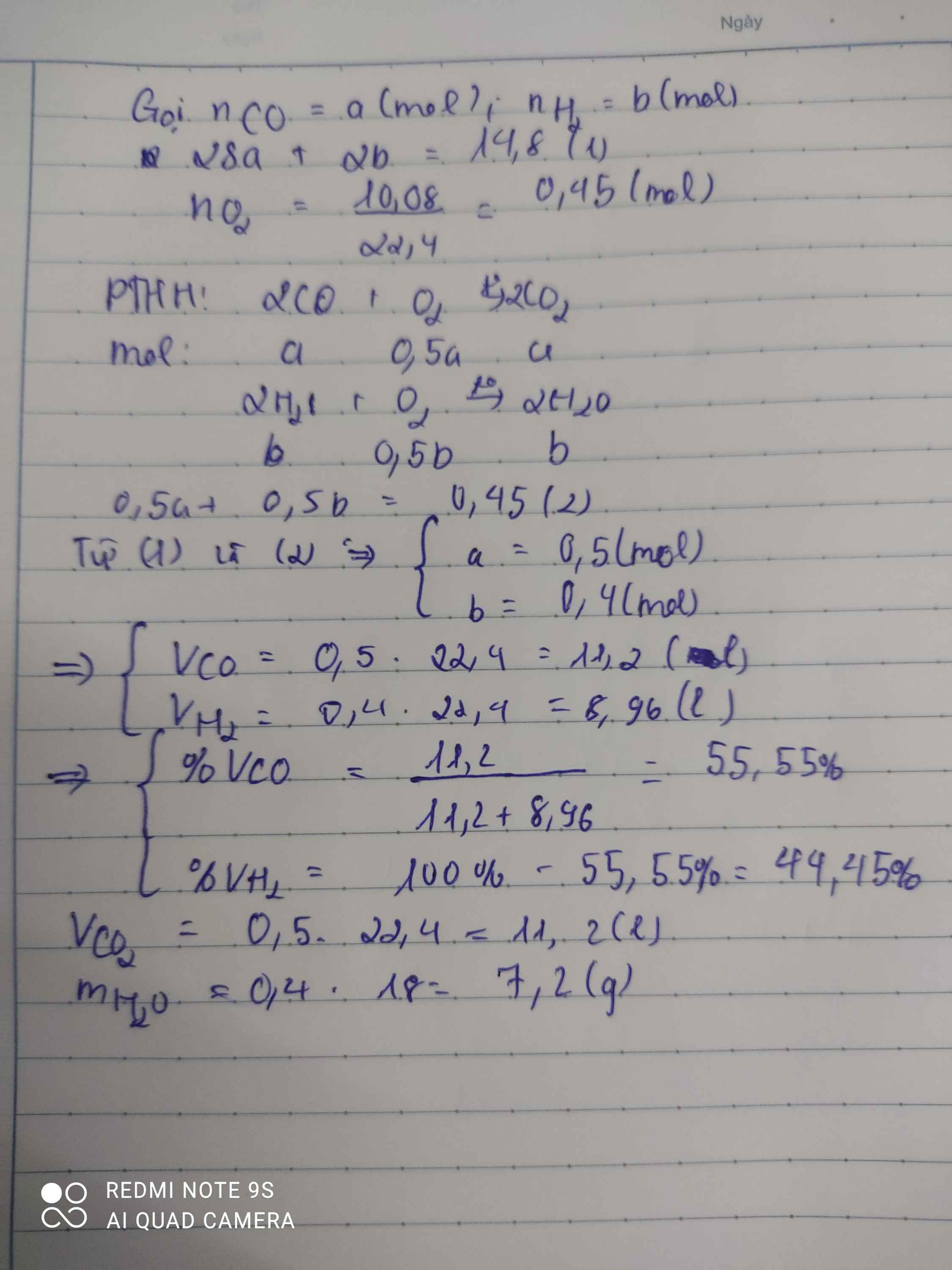1. Đốt cháy hoàn toàn 3,7 g hỗn hợp khí Z ( đktc ) gồm metan và butan ( C4H10 ) thu được 11g khí CO2 . Tính thành phần phần trăm khối lượng mỗi khí trong hỗn hợp ban đầu

Những câu hỏi liên quan
Đốt cháy hoàn toàn 3,7 gam hỗn hợp khí Z gồm metan và butan C 4 H 10 . Sau khi kết thúc phản ứng, thu được 11 gam khí C O 2 . Tính thành phần phần trăm theo khối lượng mỗi khí trong hỗn hợp ban đầu.
Đốt cháy hoàn toàn 3.7g hỗn hợp khí X gồm metan (CH4) và butan (C4H10). Sau khi kết thúc phản ứng thu được 11g khí CO2. Tính thành phần phần trăm theo khối lượng mỗi khí trong hỗn hợp ban đầu.
PTHH: CH4 + 2O2 → CO2 ↑ + 2H2O
2C4H10 + 13O2 → 8CO2 ↑ + 10H2O
( Gọi a là số mol của CH4 và 2b là số mol của C4H10 => Số mol của CO2 ở pt (1) là: a và số mol CO2 ở pt (2) là: 8b )
Theo đề bài ra ta có hệ phương trình sau:
16a + 58. 2b = 3,7
44a + 44. 8b = 11
=> a = 0,05 ; b = 0,025
Khối lượng của khí metan trong hỗn hợp ban đầu là:
16 . 0,05 = 0,8 (gam)
Khối lượng của khí butan trong hỗn hợp ban đầu là:
58 . 2. 0,025 = 2,9 (gam)
Đúng 1
Bình luận (5)
Câu 6Đốt cháy hoàn toàn 6,72lít hỗn hợp khí gồm metan và axetilen, thu được 7,84 lít khí CO2 ở đktc. a. Tính phần trăm theo thể tích của mỗi khí trong hỗn hợp A :b. Tính khối lượng của oxi cần để đốt cháy hoàn toàn hỗn hợp khí trên.
Đọc tiếp
Câu 6
Đốt cháy hoàn toàn 6,72lít hỗn hợp khí gồm metan và axetilen, thu được 7,84 lít khí CO2 ở đktc.
a. Tính phần trăm theo thể tích của mỗi khí trong hỗn hợp A :
b. Tính khối lượng của oxi cần để đốt cháy hoàn toàn hỗn hợp khí trên.
a, \(CH_4+2O_2\underrightarrow{t^o}CO_2+2H_2O\)
\(2C_2H_2+5O_2\underrightarrow{t^o}4CO_2+2H_2O\)
Ta có: \(n_{CH_4}+n_{C_2H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\left(1\right)\)
\(n_{CO_2}=n_{CH_4}+2n_{C_2H_2}=\dfrac{7,84}{22,4}=0,35\left(mol\right)\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{CH_4}=0,25\left(mol\right)\\n_{C_2H_2}=0,05\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%V_{CH_4}=\dfrac{0,25.22,4}{6,72}.100\%\approx83,33\%\\\%V_{C_2H_2}\approx16,67\%\end{matrix}\right.\)
Theo PT: \(n_{O_2}=2n_{CH_4}+\dfrac{5}{2}n_{C_2H_2}=0,625\left(mol\right)\Rightarrow m_{O_2}=0,625.32=20\left(g\right)\)
Đúng 3
Bình luận (1)
Đốt cháy hoàn toàn 5,60 lít hỗn hợp khí A gồm metan và etan thu được 8,96 lít khí cacbonic. Các thể khí được đo ở đktc. Tính thành phần phần trăm về thể tích và phần trăm khối lượng của mỗi khí trong hỗn hợp A
- Gọi mol metan và etan là x, y ( mol )
\(x+y=n_{hh}=\dfrac{V}{22,4}=0,25\left(mol\right)\)
Lại có : \(x+2y=n_{CO_2}=\dfrac{V}{22,4}=0,4\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}x=0,1\\y=0,15\end{matrix}\right.\) ( mol )
\(\Rightarrow\left\{{}\begin{matrix}m_{CH_4}=1,6\left(g\right)\\m_{C_2H_6}=4,5\left(g\right)\end{matrix}\right.\)
=> mhh = 6,1 ( g )
=> %mCH4 = ~ 26,22%
=> %mC2H6 = ~73,78%
Ta có : \(\%V_{CH4}=\dfrac{V}{Vhh}=40\%\)
=> %VC2H6 = 100 - %VCH4 = 60% .
Đúng 2
Bình luận (1)
PT: \(CH_4+2O_2\underrightarrow{t^o}CO_2+2H_2O\)
\(2C_2H_6+5O_2\underrightarrow{t^o}4CO_2+6H_2O\)
Giả sử: \(\left\{{}\begin{matrix}n_{CH_4}=x\left(mol\right)\\n_{C_2H_6}=y\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow x+y=\dfrac{5,6}{22,4}=0,25\left(1\right)\)
Ta có: \(n_{CO_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
Theo PT: \(\Sigma n_{CO_2}=n_{CH_4}+2n_{C_2H_6}\)
\(\Rightarrow x+2y=0,4\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,1\left(mol\right)\\y=0,15\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%V_{CH_4}=\dfrac{0,1}{0,25}.100\%=40\%\\\%V_{C_2H_6}=60\%\end{matrix}\right.\)
\(\left\{{}\begin{matrix}\%m_{CH_4}=\dfrac{0,1.16}{0,1.16+0,15.30}.100\%\approx26,2\%\\\%m_{C_2H_6}\approx73,8\%\end{matrix}\right.\)
Bạn tham khảo nhé!
Đúng 2
Bình luận (1)
Gọi :
\(n_{CH_4} = a(mol) ; n_{C_2H_6} = b(mol)\\ \Rightarrow a + b = \dfrac{5,6}{22,4} = 0,25(1)\\ CH_4 + 2O_2 \xrightarrow{t^o} CO_2 + 2H_2O\\ C_2H_6 + \dfrac{7}{2}O_2 \xrightarrow{t^o} 2CO_2 + 3H_2O\\ n_{CO_2} = a + 2b = \dfrac{8,96}{22,4} = 0,4(2)\)
Từ (1)(2) suy ra: a = 0,1 ; b = 0,15
Vậy :
\(\%V_{CH_4} = \dfrac{0,1.22,4}{5,6}.100\% = 40\%\\ \%V_{C_2H_6} = 100\% - 40\% = 60\%\\ \%m_{CH_4} = \dfrac{0,1.16}{0,1.16 +0,15.30}.100\% = 26,23\%\\ \%m_{C_2H_6} = 100\% - 26,23\% = 73,77\%\)
Đúng 0
Bình luận (1)
Đốt cháy hoàn toàn 14,8 g hỗn hợp khí gồm CO và H2 cần dùng 10,08 l khí O2 Tính:
a. Thành phần % về thể tích mỗi khí trong hỗn hợp ban đầu(đktc)
b. Thể tích khí CO2 và khối lượng nước thu được(đktc)
Đốt cháy hoàn toàn 3,36 lít khí hỗn hợp khí metan và etan thu được 4,48 lít khí CO2(đktc).Tính thành phần phần trăm về thể tích của mỗi khí trong hỗn hợp A .
\(n_{CH_4} = a\ mol ;n_{C_2H_6} = b\ mol\\ \Rightarrow a + b = \dfrac{3,36}{22,4}= 0,15(1)\\ CH_4 + 2O_2 \xrightarrow{t^o} CO_2 + 2H_2O\\ C_2H_6 + \dfrac{7}{2}O_2 \xrightarrow{t^o} 2CO_2 + 3H_2O\\ n_{CO_2} = a + 2b = \dfrac{4,48}{22,4} = 0,2(2)\\ (1)(2) \Rightarrow a = 0,1 ;b = 0,05\\ \Rightarrow \%V_{CH_4} = \dfrac{0,1}{0,15}.100\% = 66,67\%\\ \%V_{C_2H_6} = 100\% - 66,67\% = 33,33\%\)
Đúng 3
Bình luận (0)
\(n_{CH_4}=a\left(mol\right),n_{C_2H_6}=b\left(mol\right)\)
\(\Rightarrow a+b=0.15\left(mol\right)\left(1\right)\)
\(n_{CO_2}=\dfrac{4.48}{22.4}=0.2\left(mol\right)\)
\(\Rightarrow a+2b=0.2\left(2\right)\)
\(\left(1\right),\left(2\right):a=0.1,b=0.05\)
\(\%CH_4=\dfrac{0.1}{0.15}\cdot100\%=66.67\%\)
\(\%C_2H_6=33.33\%\)
Đúng 1
Bình luận (0)
Gọi số mol của metan là x, số mol của etan là y
nA = 0,150 mol = x+ y (1)
(n_{CO_{2}}) = 0,20 mol = x + 2y (2)
Từ (1) và (2) => x = 0,100; y = 0,0500
=> %(V_{CH_{4}}) = 66,7% và %(V_{C_{2}H_{6}}) = 33,3%
Đúng 1
Bình luận (0)
Đốt cháy hoàn toàn 3,36 lít hỗn hợp khí metan và etan thu được 4,48 lít khí CO2 (đktc). Tính thành phần phần trăm về thể tích của mỗi khí trong hỗn hợp A. A. % VCH4 66,67 %, %VC2H6 33,33 % B. % VCH4 76,65%, %VC2H6 24,45% C. % VCH4 33,33 %, %VC2H6 66,67 % D. % VCH4 33,34 %, %VC2H6 66,66 %
Đọc tiếp
Đốt cháy hoàn toàn 3,36 lít hỗn hợp khí metan và etan thu được 4,48 lít khí CO2 (đktc). Tính thành phần phần trăm về thể tích của mỗi khí trong hỗn hợp A.
A. % VCH4 = 66,67 %, %VC2H6 = 33,33 %
B. % VCH4 = 76,65%, %VC2H6 = 24,45%
C. % VCH4 = 33,33 %, %VC2H6 = 66,67 %
D. % VCH4 = 33,34 %, %VC2H6 = 66,66 %
CH4 -> CO2
C2H6 -> 2 CO2
Gọi nCH4 = x mol, nC2H6 = y mol
x + y = 0,15 (1)
x + 2y = 0,2 (2)
Nên: x = 0,1 mol, y = 0,05 mol
Vậy: % VCH4 = 66,67 % => %VC2H6 = 33,33 %
Đúng 0
Bình luận (0)
Đốt cháy hoàn toàn một hỗn hợp khí Z gồm CO và H 2 cần dùng 4,48 lít khí O 2 (đktc). Thể tích khí sinh ra chứa 3,36 lít C O 2 . Hãy tính thành phần phần trăm theo thể tích mỗi khí trong hỗn hợp ban đầu.
đốt cháy hoàn toàn 4,48 lít hỗn hợp metan và etylen cần dùng 15,68 lít khí o2 (các khí đo ở đktc) a viết ptpư b thể tích mỗi khí có trong hỗn hợp ban đầu c thể tích co2 thu được d tính thành phần % của mỗi khí trong hỗn hợp ban đầu
Đốt cháy hoàn toàn 9,96 l (điều kiện tiêu chuẩn ) hỗn hợp khí gồm CH4 và C2H6 trong ko khí thu đc CO2 và H2O bt khối lượng CO2+ 28,6(g) . Hãy tính thành phần % trong mỗi khí ban đầu
Đề bài là 8,96 lít hay 9,96 lít em hầy?
Đúng 0
Bình luận (4)