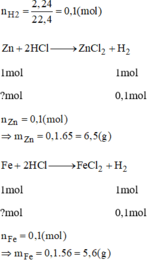Để điều chế hydro từ kẽm và axit HCl phải dùng bao nhiêu gam kẽm để điều chế 2,24
lít khí H 2 (đktc)
A. 13 gam. B. 5,5 gam. .
C. 6,5 gam D. 7,5 gam

Những câu hỏi liên quan
Trong phòng thí nghiệm hóa học có các kim loại kẽm và sắt, dung dịch HCl và axit H2SO4.
a) Viết các phương trình hóa học có thể điều chế hiđro;
b) Phải dùng bao nhiêu gam kẽm, bao nhiêu gam sắt để điều chế được 2,24 lít khí hiđro (đktc)?
Phương trình hóa học của phản ứng:
Fe + H2SO4 → FeSO4 + H2.
Zn + H2SO4 → ZnSO4 + H2.
Fe + 2HCl → FeCl2 + H2.
Zn + 2HCl → ZnCl2 + H2.
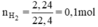
Theo phương trình (3) mFe cần dùng: 56.0,1 = 5,6g.
Theo phương trình (4) mZn cần dùng: 65.0,1 = 6,5g.
Đúng 0
Bình luận (0)
Trong phòng thí nghiệm có các kim loại kẽm và sắt, dung dịch axit clohiđric HCl và axit sunfuric H2SO4 loãng:
a. Viết phương trình hóa học có thể điều chế hi đro;
b. Phải dùng bao nhiêu gam kẽm, bao nhiêu gam sắt để diều chế được 2,24 lít khí hiđro (ở đktc)?
Xem chi tiết
\(Zn + 2HCl \to ZnCl_2 + H_2\\ Zn + H_2SO_4 \to ZnSO_4 + H_2\\ Fe + 2HCl \to FeCl_2 + H_2\\ Fe + H_2SO_4 \to FeSO_4 + H_2\\ n_{Fe} = n_{Zn} = n_{H_2} = \dfrac{2,24}{22,4} = 0,1(mol)\\ m_{Fe} = 0,1.56 = 5,6(gam) ; m_{Zn} = 0,1.65 = 6,5(gam)\)
Đúng 3
Bình luận (2)
Trong phòng thí nghiệm có các kim loại kẽm và sắt, dung dịch axit clohiđric HCl và axit sunfuric H2SO4 loãng:
a. Viết phương trình hóa học có thể điều chế hi đro;
b. Phải dùng bao nhiêu gam kẽm, bao nhiêu gam sắt để diều chế được 2,24 lít khí hiđro (ở đktc)?
a. Phương trình hóa học có thể điều chế hiđro.
Zn + 2HCl → ZnCl2 + H2
Fe + H2SO4 (loãng) → FeSO4 + H2
Zn + H2SO4 → ZnSO4 + H2
Fe + 2HCl → FeCl2 + H2
b. Số mol khí hiđro là: n = 0,1 (mol)
Khối lượng kẽm cần dùng là: m = 0,1x65 = 6,5 (g)
Khối lượng sắt cần dùng là: m = 0,1x56 = 5,6 (g).
Đúng 1
Bình luận (1)
a) Các PTHH biểu diễn phản ứng điều chế khí H2 trong phòng thí nghiệm dựa vào các hóa chất : HCl, H2SO4 loãng, Zn và Fe là:
(1) Zn + 2HCl -> ZnCl2 + H2\(\uparrow\)
(2) Fe + 2HCl -> FeCl2 + H2\(\uparrow\)
(3) Zn + H2SO4 (loãng) -> ZnSO4 + H2\(\uparrow\)
(4) Fe + H2SO4 (loãng) -> FeSO4 + H2\(\uparrow\)
b) Ta có: \(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
Theo các PTHH và đề bài, ta có:
\(n_{Zn\left(1\right)}=n_{Fe\left(2\right)}=n_{Zn\left(3\right)}=n_{Fe\left(4\right)}=n_{H_2}=0,1\left(mol\right)\)
- Khối lượng kẽm cần dùng : \(m_{Zn}=0,1.65=6,5\left(g\right)\)
- Khối lượng sắt cần dùng: \(m_{Fe}=0,1.56=5,6\left(g\right)\)
Đúng 0
Bình luận (0)
a. Phương trình hóa học có thể điều chế hiđro.
Zn + 2HCl → ZnCl2 + H2 ↑
Fe + H2SO4 (loãng) → FeSO4 + H2 ↑
Zn + H2SO4 → ZnSO4 + H2 ↑
Fe + 2HCl → FeCl2 + H2 ↑
b. Số mol khí hiđro là: n = = 0,1 (mol)
Khối lượng kẽm cần dùng là: m = 0,1x65 = 6,5 (g)
Khối lượng sắt cần dùng là: m = 0,1x56 = 5,6 (g).
Đúng 0
Bình luận (0)
Xem thêm câu trả lời
Người ta cho kẽm hoặc sắt tác dụng với dung dịch axit clohidric HCl để điều chế khí hidro. Nếu muốn điều chế 2,24l khí hidro (đktc) thì phải dùng số gam kẽm hoặc sắt lần lượt là:
A. 6,5g và 5,6g B. 16g và 8g
C. 13g và 11,2g D. 9,75g và 8,4g
Hiđro là một chất khí nhẹ nhất, thường được ứng dụng để bơm vào khinh khí cầu bóng thám không. Trong phòng thí nghiệm, hiđro được điều chế bằng cách cho kẽm tác dụng với axit clohiđric (HCl), sản phẩm phản ứng là muối kẽm clorua (ZnCl2) và khí hiđro (H2)a) Tính thể tích khí hiđro thu được (ở đktc) khi cho 6,5 gam Zn phản ứng hết với dung dịch HClb) Tính khối lượng HCl cần dùng để phản ứng vừa đủ với 6,5 gam Zn. Cho: H 1 ; Cl 35,6 ; Zn 65
Đọc tiếp
Hiđro là một chất khí nhẹ nhất, thường được ứng dụng để bơm vào khinh khí cầu bóng thám không. Trong phòng thí nghiệm, hiđro được điều chế bằng cách cho kẽm tác dụng với axit clohiđric (HCl), sản phẩm phản ứng là muối kẽm clorua (ZnCl2) và khí hiđro (H2)
a) Tính thể tích khí hiđro thu được (ở đktc) khi cho 6,5 gam Zn phản ứng hết với dung dịch HCl
b) Tính khối lượng HCl cần dùng để phản ứng vừa đủ với 6,5 gam Zn.
Cho: H = 1 ; Cl = 35,6 ; Zn = 65
số mol kẽm tham gia phản ứng là:\(n_{Zn}=\frac{m}{M}=\frac{6,5}{65}=0,1\left(mol\right)\)
PTHH:
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,1 0,2 0,1 (mol)
a, thể tích khí hiđro thu được là:\(V_{H_2}=n_{H_2}\times22,4=0,1\times22,4=2,24\left(l\right)\)
b,khối lượng HCl cần dùng là:\(m_{HCl}=n_{HCl}\times M=0,2\times65=13\left(g\right)\)
Đúng 0
Bình luận (4)
số mol kẽm tham gia phản ứng là:nZn=mM=6,565=0,1(mol)nZn=mM=6,565=0,1(mol)
PTHH:
Zn+2HCl→ZnCl2+H2Zn+2HCl→ZnCl2+H2
0,1 0,2 0,1 (mol)
a):VH2=nH2×22,4=0,1×22,4=2,24(l)VH2=nH2×22,4=0,1×22,4=2,24(l)
b):mHCl=nHCl×M=0,2×65=13(g)
Đúng 0
Bình luận (0)
Thể tích khí SO2 thu được ở đktc khi đốt cháy hoàn toàn 3,2 gam lưu huỳnh là bao nhiêu?A. 1,12 lít B. 2,24 lít C. 3,36 lít D. 4,48 lítCâu 30. Khối lượng KClO3 cần dùng để điều chế được 3,36 lít khí oxi ở đktc là bao nhiêu?A. 6,125 gam B. 12,25 gam C. 18,375 gam D. 24,5 gamCâu 31. Khối lượng KMnO4 cần dùng để điều chế được 2,24 lít khí oxi ở đktc là bao nhiêu?A. 15,8 gam B. 23,7 gam C. 31,6 gam D. 47,4 gam.Câu 32. Thể tích khí H2 cần dùng ở đktc để khử hoàn toàn 8 gam đồng oxit (CuO) là bao nhiêu...
Đọc tiếp
Thể tích khí SO2 thu được ở đktc khi đốt cháy hoàn toàn 3,2 gam lưu huỳnh là bao nhiêu?
A. 1,12 lít B. 2,24 lít C. 3,36 lít D. 4,48 lít
Câu 30. Khối lượng KClO3 cần dùng để điều chế được 3,36 lít khí oxi ở đktc là bao nhiêu?
A. 6,125 gam B. 12,25 gam C. 18,375 gam D. 24,5 gam
Câu 31. Khối lượng KMnO4 cần dùng để điều chế được 2,24 lít khí oxi ở đktc là bao nhiêu?
A. 15,8 gam B. 23,7 gam C. 31,6 gam D. 47,4 gam.
Câu 32. Thể tích khí H2 cần dùng ở đktc để khử hoàn toàn 8 gam đồng oxit (CuO) là bao nhiêu?
A. 1,12 lít B. 2,24 lít C. 3,36 lít D. 4,48 lít
Câu 33. Khối lượng kim loại thu được khi cho 23,2 gam Ag2O phản ứng hoàn toàn với H2 dư, nung nóng là bao nhiêu?
A. 10,8 gam B. 16, 2 gam C. 21,6 gam D. 43,2 gam
Câu 34. Khối lượng chất rắn thu được khi đốt cháy 15,5 gam photpho trong bình chứa 11,2 lít khí oxi (ở đktc) là bao nhiêu?
A. 28,4 gam B. 35,5 gam C. 31,5 gam D. 56,8 gam
Câu 35. Khử hoàn toàn 46,4 gam hỗn hợp oxit CuO, FeO, Ag2O bằng V lít khí H2 vừa đủ, sau phản ứng thu được 40 gam kim loại. Giá trị của V là bao nhiêu?
A. 2,24 lít B. 4,48 lít C. 8,96 lít D. 13,44 lít
Trong phòng thí nghiệm có các kim loại kẽm và sắt, dung dịch axit clohiđric HCl và axit sunfuric H\(_2\)SO\(_4\) loãng:
a. Viết phương trình hóa học có thể điều chế hi đro;
b. Phải dùng bao nhiêu gam kẽm, bao nhiêu gam sắt để diều chế được 2,24 lít khí hiđro (ở đktc)?
a. Phương trình hóa học có thể điều chế hiđro.
Zn + 2HCl → ZnCl2 + H2 ↑
Fe + H2SO4 (loãng) → FeSO4 + H2 ↑
Zn + H2SO4 → ZnSO4 + H2 ↑
Fe + 2HCl → FeCl2 + H2 ↑
b. Ta có
nH2 = \(\dfrac{2,24}{22,4}\) = 0,1 (mol)
mzn = 0,1 . 65 = 6,5 ( gam )
mFe = 0,1 . 56 = 5,6 ( gam ).
Đúng 1
Bình luận (0)
a. Phương trình hóa học có thể điều chế hiđro.
Zn + 2HCl → ZnCl2 + H2 ↑
Fe + H2SO4 (loãng) → FeSO4 + H2 ↑
Zn + H2SO4 → ZnSO4 + H2 ↑
Fe + 2HCl → FeCl2 + H2 ↑
b. Số mol khí hiđro là: n = \(\dfrac{2,24}{22,4}\)= 0,1 (mol)
Khối lượng kẽm cần dùng là: m = 0,1x65 = 6,5 (g)
Khối lượng sắt cần dùng là: m = 0,1x56 = 5,6 (g).
Đúng 1
Bình luận (0)
Cho 6,5 kim loại kẽm vào 10g dung dịch HCl để điều chế H2 a) Phản ứng xong chất nào còn dư và dư bao nhiêu gam ? b) Tính chất tích H2 sinh ( đktc )
"Đề bài thiều nồng độ phần trăm của HCl trong dung dịch"
\(Zn + 2HCl \to ZnCl_2 + H_2\\ n_{H_2} = n_{Zn} = \dfrac{6,5}{65} = 0,1(mol)\\ \Rightarrow V_{H_2} = 0,1.22,4 = 2,24(lít)\)
Đúng 1
Bình luận (0)
nZn = 6.5/65 = 0.1 (mol)
nHCl = 10/36.5 = 0.27 (mol)
Zn + 2HCl => ZnCl2 + H2
0.1___0.2__________0.1
m HCl dư = 10 - 0.2*36.5 = 2.7(g)
VH2 = 0.1*22.4 = 2.24 (l)
Đúng 0
Bình luận (0)
điều chế kẽm oxit (ZnO) bằng cách đốt kẽm trong oxi.
a) tính thể tích oxi (đktc) cần dùng để điều chế 40,5 g kẽm oxit
b) muốn có thể tích oxi nói trên cần phải phân hủy bao nhiêu gam kaliclorat
Zn + 1/2O2 ---> ZnO
nO2 = 1/2nZnO = 40,5/81/2 = 0,25 mol ---> V = 0,25.22,5 = 5,6 lít.
b) KClO3 ---> KCl + 3/2O2
nKClO3 = 2/3nO2 = 0,5/3 mol ---> m = 122,5.0,5/3 = 20,42 gam.
Đúng 0
Bình luận (0)
a)Pt 2Zn + O2 \(\underrightarrow{t^o}\) 2 ZnO
-nZnO=\(\dfrac{40.5}{81}=0.5\left(mol\right)\)
-Theo pt thì nO2=\(\dfrac{1}{2}\) nZnO=0.25(mol)
=>VO2=0,25.22.4=5.6(l)
Đúng 0
Bình luận (0)
b) Pt : 2KClO3\(\underrightarrow{t^o}\) 2KCl + 3O2
-Theo phương trình : nKClO3=\(\dfrac{2}{3}\) nO2=\(\dfrac{1}{6}\left(mol\right)\)
=>mKClO3=1/6.122.5=24.42(g)
Vậy...
Đúng 0
Bình luận (0)